
 A、B、C、D、E、F是初中化学常见的六种物质,其中A和B、C和D组成的元素种类相同,它们之间的转化关系如图所示((图中“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系,图中已略去部分物质).
A、B、C、D、E、F是初中化学常见的六种物质,其中A和B、C和D组成的元素种类相同,它们之间的转化关系如图所示((图中“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系,图中已略去部分物质).分析 A、B、C、D、E、F是初中化学常见的六种物质,其中A和B、C和D组成的元素种类相同,由转化可知A为CO、B为CO2,D为H2O2,C为H2O,若E和F均由两种元素组成,则E、F分别为CH4、HCl中的一种,若E和F均由三种元素组成,可以是碳酸钠与硫酸反应,也可以是碳酸钙与盐酸反应.
解答 解:A、B、C、D、E、F是初中化学常见的六种物质,其中A和B、C和D组成的元素种类相同,由转化可知A为CO、B为CO2,D为H2O2,C为H2O.
(1)A的化学式为CO,D→C的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,故答案为:CO;2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(2)若E和F均由两种元素组成,则E、F分别为CH4、HCl中的一种,故答案为:CH4或HCl;
(3)若E和F均由三种元素组成,可以是碳酸钠与硫酸反应,也可以是碳酸钙与盐酸反应,F→B+C的反应方程式:H2SO4+Na2CO3=Na2SO4+H2O+CO2↑或CaCO3+2HCl=CaCl2+H2O+CO2↑,
故答案为:H2SO4+Na2CO3=Na2SO4+H2O+CO2↑或CaCO3+2HCl=CaCl2+H2O+CO2↑.
点评 本题考查无机物推断,属于猜测验证型,需要学生元素化合物知识,注意为初中常见物质之间的反应,难度不大.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 镁属于金属元素 | |
| B. | 镁离子核内有12个质子 | |
| C. | 镁离子与硫离子的电子层数相等 | |
| D. | 在化学反应中,1个硫原子容易得到2个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
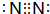 ,物质甲分子的结构式
,物质甲分子的结构式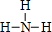 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | |||||

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯使溴水层褪色属于加成反应 | |
| B. | 乙烯与水反应生成乙醇属于水解反应 | |
| C. | 同二甲苯只有一种结构说明苯分子中不存在单双链交替 | |
| D. | 等质量环丁烷(C4H8)和乙烯(C2H4)完全燃烧,消耗的氧气量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ,其核磁共振氢谱中有2个吸收峰.
,其核磁共振氢谱中有2个吸收峰.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com