
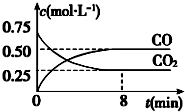
 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.| 甲 | 乙 | |
| 量 | 3mo Fe、 mo CO | mo FeO、 3mo CO |
| CO浓度(mo•-1) | c1 | c |
| CO体积分数 | φ1 | φ |
| 体系压强(Pa) | p1 | p |
| 气态转化率 | α1 | α |
分析 (1)依据平衡常数概念写出,用生成物平衡浓度幂次方乘积除以反应物平衡浓度的幂次方乘积得到;
(2)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(3)8分钟内,一氧化碳难度变化0.5mol/L,依据V=$\frac{△c}{△t}$计算CO的平均反应速率;
(4)Fe(s)+CO2(g)?FeO(s)+CO(g),反应是气体体积不变的吸热反应,依据
①依据图表数据分析,反应前后气体体积不变,加入2molCO2,加入3mol CO,相当于加入3molCO2,的平衡状态,气体物质条件分数相同,物质的量不同,压强不同,气体物质的量大的容器中压强大,起始量不同,平衡浓度、转化率不同;
②依据题干计算平衡常数,结合化学平衡三段式列式计算.
解答 解:(1)Fe(s)+CO2(g)?FeO(s)+CO(g),依据平衡常数概念书写,注意固体和纯液体不写入表达式,表达式为:K=$\frac{c(CO)}{c(C{O}_{2})}$;
故答案为:$\frac{c(CO)}{c(C{O}_{2})}$;
(2)A.固体总质量保持不变,说明反应达平衡状态,故A正确;
B.气体密度不变,说明气体的物质的量不变,反应达平衡状态,故B正确;
C.固体的浓度是一个定值,故C错误;
D.CO2与CO浓度不变,而不是相等,故D错误;
故答案为:AB;
(3)依据图象分析,8分钟内,一氧化碳浓度变化0.5mol/L,CO的平均反应速率v(CO)=$\frac{0.5mol/L}{8min}$=0.0625mol/L•min;
故答案为:0.062 5;
(4)①依据图表数据分析,反应前后气体体积不变,加入2molCO2,加入3mol CO,相当于加入3molCO2,平衡时气体体积分数相同,物质的量不同,压强不同,气体物质的量大的容器中压强大,起始量不同,平衡浓度、转化率不同;
A.达到平衡状态,一氧化碳的浓度关系为:3c1=2c2,故A错误;
B.反应物和生成物都是一种,平衡常数相同,所以达到平衡状态二氧化碳的体积分数相同,φ1=φ2,故B正确;
C.乙容器中气体物质的量大于甲容器,所以达到平衡状态p1<p2,故C正确;
D.起始量不同,甲容器正向进行,乙容器逆向进行,反应前后气体体积不变,气态反应物的转化率不相同,故D错误;
故答案为:BC;
②图象分析反应在1100°C反应的平衡常数K=$\frac{0.50}{0.25}$=2
甲容器中设反应的二氧化碳浓度为x
Fe(s)+CO2(g)?FeO(s)+CO(g),
起始量(mol/L) 1 0
变化量(mol/L) x x
平衡量(mol/L) 1-x x
K=$\frac{x}{1-x}$=2
x=$\frac{2}{3}$mol/L
平衡状态一氧化碳的浓度=$\frac{2}{3}$(mol/L)=0.67mol/L,
CO2的体积分数φ1=$\frac{1-x}{1}$×100%=$\frac{1}{3}$×100%=33.3%;
乙容器中温度和甲容器相同,平衡常数相同,所以二氧化碳的体积分数φ2=φ1 =33.3%;
故答案为:0.67mol•L-1;33.3%;33.3%.
点评 本题考查化学平衡影响因素、等效平衡、化学平衡的计算,题目计算量较大,难度较大,关键是构建平衡建立的等效途径.


科目:高中化学 来源: 题型:选择题
| A. | 铝的氧化物可用作于耐高温材料 | B. | Na2O2可用作漂白剂 | ||
| C. | 碱石灰可用于干燥CO2、O2等气体 | D. | 小苏打可用于治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | H+ | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 未测定 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
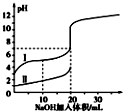 室温下,用 0.100mol/L NaOH 溶液分别与 20.00mL 0.100mol/L 的盐酸和醋酸反应,pH 与滴入碱的体积关系如图所示. 已知醋酸电离常数 K=1.7×10 -5下列说法正确的是( )
室温下,用 0.100mol/L NaOH 溶液分别与 20.00mL 0.100mol/L 的盐酸和醋酸反应,pH 与滴入碱的体积关系如图所示. 已知醋酸电离常数 K=1.7×10 -5下列说法正确的是( )| A. | Ⅰ、Ⅱ分别表示盐酸和醋酸的反应曲线 | |
| B. | pH=7 时,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=170 | |
| C. | V(NaOH)=10.00 mL 时,醋酸溶液的导电性更强 | |
| D. | 向盐酸中加 NaOH 至 pH=12 时,V(NaOH)=200/9 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH的燃烧热为192.9 kJ/mol | |
| B. | CH3OH转变成H2的过程不一定要吸收能量 | |
| C. | 根据①②推知反应:H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+241.9 kJ/mol | |
| D. | 根据②推知反应:CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H>-192.9 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
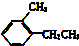 ②
② ③
③ ④TNT
④TNT查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al→[Al(OH)4]- | B. | Na2CO3→NaOH | C. | Al2O3→Al(OH)3 | D. | Fe(OH)2→Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
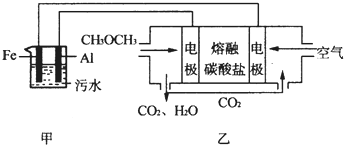
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com