
以NA表示阿伏加德罗常数,下列说法正确的是
A.在标准状况下,11.2 L己烷含有分子数为0.5NA
B.4.2 g乙烯和环丙烷的混合气体含有H原子数为0.6NA
C.甲基﹝-CH3﹞的电子总数为10NA
D.在常温常压下,2.24 L丁烷和2—甲基丙烷的混合气体所含分子数为0.1NA
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.反应热就是反应中放出的能量
B.放热反应在常温下一定很容易发生
C.由C(石墨) C(金刚石) ΔH=+1.9 kJ·mol-1可知,金刚石比石墨稳定
C(金刚石) ΔH=+1.9 kJ·mol-1可知,金刚石比石墨稳定
D.等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化是通过取代反应来实现的是 ( )
A.CH3CH2OH CH3CHO
CH3CHO
B.CH2 CH2
CH2 CH3—CH2Br
CH3—CH2Br
C.CH2 CH2+H2O
CH2+H2O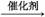 CH3CH2OH
CH3CH2OH
D.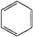

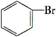
查看答案和解析>>
科目:高中化学 来源: 题型:
最近科学家在-100 ℃的低温下合成了一种烃X,其核磁共振氢谱表明该分子中的氢原子的化学环境没有区别,根据分析,绘制了如图所示的球棍模型。下列说法中错误的是( )
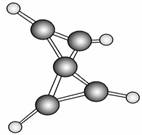 A.烃X的分子式为C5H4
A.烃X的分子式为C5H4
B.分子中碳原子的化学环境有2种
C.该有机物含有官能团
D.X分子中只有碳碳单键,没有碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
从香料八角中提取的有机物A可制得抗禽流感病毒的特效药“达菲”。
(1)经测定,A的相对分子质量在150~200之间,含碳的质量分数为48.3%,含氢的质量分数为5.7%,其余为氧,则A的分子式为_______________________。
(2)1 mol A能与足量NaHCO3反应得到标准状况下的CO2 22.4 L,与足量金属钠反应得到标准状况下的H2 44.8 L,能与1 mol Br2发生加成反应。将A分子中含有官能团的名称及数目填入下表(可不填满也可补充):
| 官能团名称 | ||||
| 官能团数目 |
(3)A与等物质的量的H2加成后生成B。A的红外光谱显示其分子中除了含有上述官能团外,还含有一个六元碳环,B的核磁共振氢谱显示其分子中有7种不同化学环境的氢原子。已知羟基连在双键碳原子上是不稳定的,两个羟基连在同一碳原子上也是不稳定的,则A的结构简式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解一定量的硫酸铜溶液,电解一段时间后,向电解液加入0.1 mol碱式
碳铜晶体(不含结晶水),恰好使溶液恢复到电解前的浓度和pH。下列有关叙述不正确的是
A.电解过程产生的气体体积(在标准状况下)为5.6 L
B.电解过程只发生了2CuSO4+2H2O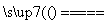 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
C.电解过程转移的电子数为3.612×1023个
D.加入的碱式碳酸铜的反应是:Cu2(OH)2CO3+2H2SO4====2CuSO4+CO2↑+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知如下两个热化学反应方程式。

下列说法不正确的是( )
A.反应①、②都属于加成反应
B.在通常条件下,反应①、②都能自发进行
C.反应①吸热、反应②放热的事实说明苯环中含有的并不是碳碳双键
D.反应①、②中的所有有机物均可使溴水层褪色,但褪色原理不完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ. 乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇。写出相应反应的化学方程式:
________________________________________________________________________。
(2)已知:
甲醇脱水反应 2CH3OH(g) === CH3OCH3(g) + H2O(g) △H1 == -23.9 kJ·mol—1
甲醇制烯烃反应 2CH3OH(g) === C2H4(g) + 2H2O(g) △H2 == -29.1 kJ·mol—1
乙醇异构化反应 C2H5OH(g) === CH3OCH3(g) △H3 == + 50.7 kJ·mol—1
则乙烯气相直接水合反应C2H4(g) + H2O(g)=== C2H5OH(g)的△H == __________________________。与间接水合法相比,气相直接水合法的优点是__________________________________。
Ⅱ. 甲醇虽然毒性很强,但它是一种清洁燃料,也是一种重要的合成原料。工业甲醇的质量分数可以用下列方法测定:
①在稀硫酸中甲醇被Cr2O72-氧化成CO2和H2O,其反应为:
CH3OH + Cr2O72— + 8H+ ==== CO2↑+ 2Cr3+ + 6H2O;
②过量的Cr2O72—可用Fe2+与之完全反应,反应如下所示:
____Cr2O72— + ____Fe2+ +____H+ ――― ____Cr3+ +____Fe3+ +____H2O
现有0.12 g工业甲醇,在稀硫酸中与25.0 mL 0.2 mol/L K2Cr2O7溶液反应,多余的K2Cr2O7
恰好与9.6 mL 1.0 mol/L FeSO4溶液完全反应。
(3)请配平第②步中离子方程式(配平系数依次填写在短线上)。
(4)工业甲醇的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家宣称:普通盐水放在无线电波照射下可以燃烧,这一伟大的发现,有望解决用水作为人类能源的重大问题。无线电频率可以降低盐水中所含元素之间的“结合力”,释放出氢原子,若点火,氢原子就会在该种频率下持续燃烧。上述“结合力”实质是( )
A.分子间作用力 B.非极性共价键
C.氢键 D.极性共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com