


科目:高中化学 来源: 题型:
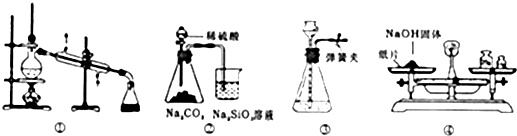
| A、装置①可用于乙醇与水的分离 | B、装置②所示实验可比较硫、碳、硅三种元素的非金属性强弱 | C、装置③,关闭弹簧夹,向长颈漏斗中注水后,长颈漏斗内水面高度保持不变能说明装置不漏气 | D、图④装置可用来称量一定质量的NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(6分)"比较"是化学研究物质性质的基本方法之一,请运用比较法解答下列问题
已知在一定条件下,过氧化钠几乎可与所有的常见气态非金属氧化物反应。
如:2Na2O2+2CO2=2Na2CO3+O2,Na2O2+CO=Na2CO3。
(1)试分别写出Na2O2与SO2、SO3反应的化学方程式。
(2)当1molSO3参加反应时,转移电子的物质的量为 mol。
(3)通过比较可知:在氧化物中,当非金属元素处于 价时,其氧化物与过氧化钠反应就有O2 生成。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年陕西省渭南市高三第二次模拟理综化学试卷(解析版) 题型:选择题
实验是化学研究的基础。下列关于各实验装置的叙述不正确的是
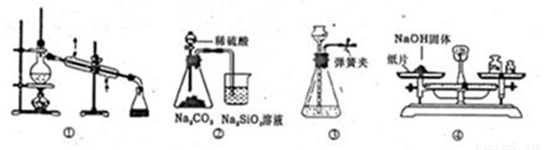
A.装置①可用于乙醇与水的分离
B.装置②所示实验可比较硫、碳、硅三种元素的非金属性强弱
C.装置③,关闭弹簧夹,向长颈漏斗中注水后,长颈漏斗内水面高度保持不变能说明装置不漏气
D.图④装置可用来称量一定质量的NaOH固体
查看答案和解析>>
科目:高中化学 来源:2010年宁夏高二下学期期末考试化学试题 题型:填空题
(6分)"比较"是化学研究物质性质的基本方法之一,请运用比较法解答下列问题
已知在一定条件下,过氧化钠几乎可与所有的常见气态非金属氧化物反应。
如:2Na2O2+2CO2=2Na2CO3+O2,Na2O2+CO=Na2CO3。
(1)试分别写出Na2O2与SO2、SO3反应的化学方程式。
(2)当1molSO3参加反应时,转移电子的物质的量为 mol。
(3)通过比较可知:在氧化物中,当非金属元素处于 价时,其氧化物与过氧化钠反应就有O2 生成。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com