
A、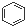 和 和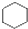 均是芳香烃, 均是芳香烃,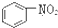 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 |
B、 和 和 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 |
| C、天然气、沼气、坑气、煤气的主要成分都是甲烷 |
| D、分子式为C4H10O的物质,可能属于醇类或醚类 |
 中不含苯环,不属于芳香烃,
中不含苯环,不属于芳香烃, 中含有氧原子,不属于芳香烃;
中含有氧原子,不属于芳香烃; 中羟基与苯环直接相连,属于酚类,而
中羟基与苯环直接相连,属于酚类,而 为苯甲醇,属于醇类;
为苯甲醇,属于醇类; 为苯,属于芳香烃,而
为苯,属于芳香烃,而 为环己烷,分子中不含苯环,不属于芳香烃,
为环己烷,分子中不含苯环,不属于芳香烃, 为硝基苯,为芳香族化合物,分子中含有氧原子,不属于芳香烃,故A错误;
为硝基苯,为芳香族化合物,分子中含有氧原子,不属于芳香烃,故A错误; 中羟基与苯环直接相连,属于酚类,而
中羟基与苯环直接相连,属于酚类,而 羟基与苯环侧链的碳原子相连,属于醇类,为苯甲醇,二者结构不同,一定不属于同系物,故B错误;
羟基与苯环侧链的碳原子相连,属于醇类,为苯甲醇,二者结构不同,一定不属于同系物,故B错误;

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
| A、Li、Na、K、Rb单质密度逐渐增大 |
| B、卤族元素随原子序数递增单质熔沸点逐渐升高 |
| C、第ⅥA元素随原子序数递增形成的氢化物熔沸点逐渐升高 |
| D、第三周期元素对应的单核离子从左到右离子半径逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴化亚铁溶液中通入足量的氯气:2Fe2++Cl2═2Fe3++2Cl- |
| B、在硫酸铜溶液中加入过量氢氧化钡溶液:Ba2++SO42-═BaSO4↓ |
| C、在澄清石灰水中通入过量二氧化碳:CO2+OH-═HCO3- |
| D、氯气溶于水:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等 |
| B、最外层电子数为8的粒子是稀有气体元素的原子 |
| C、在周期表里,主族元素所在的族序数等于原子核外电子数 |
| D、周期表中L层电子为奇数的元素所在族序数与该元素原子的L层电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
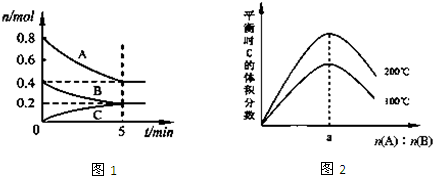
| A、200℃时,反应从开始到平衡的平均速率v(B)=0.04mol?L-1?min-1 |
| B、图2所知反应xA(g)+yB(g)?zC(g)的△H>0,且a=2 |
| C、若在图1所示的平衡状态下,再向体系中充入He,此时v正>v逆 |
| D、200℃时,向容器中充入2mol A和1mol B,达到平衡时,A的体积分数小于0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3、Al(OH)3、NaOH |
| B、Na2CO3、NaAlO2、Al2O3 |
| C、NaHCO3、NaAlO2、NaOH |
| D、Na2CO3、NaHCO3、Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有①正确 |
| B、只有②正确 |
| C、只有③正确 |
| D、全部都正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com