
| A、过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
| B、FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O |
| C、向氯化铝溶液中滴加过量氨水:Al3++4NH3?H2O═AlO42-+4NH4++2H2O |
| D、H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
| A、B与D形成的化合物为共价化合物 |
| B、E的单质能从水中置换出O2 |
| C、C的氧化物可溶于B、D、E的最高价氧化物对应的水化物溶液中 |
| D、五种元素的最高正化合价都等于其所在的族序数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
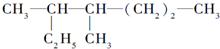 的名称是
的名称是 分子式为
分子式为查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H2)?c(CO) |
| c(H2O) |
| n(CH4) |
| n((H2O) |
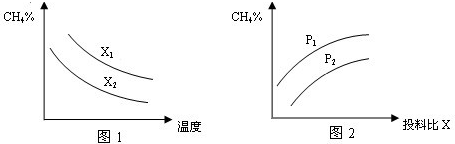
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 、④HCHO.其中碳原子采取sp2杂化的分子有
、④HCHO.其中碳原子采取sp2杂化的分子有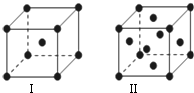
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com