
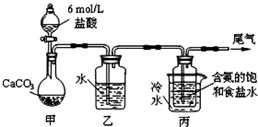
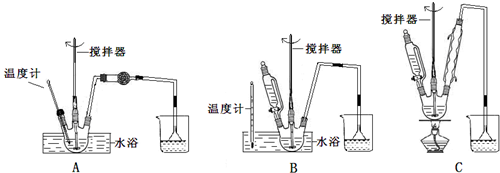
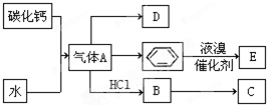
 碳酸钠俗称纯碱,在日常生产和生活中有着广泛的应用.某化学兴趣小组想根据所学知识模拟制备碳酸钠,方法如下:先以NaCl、NH3、CO2和水等为原料以及如图所示装置制取NaHCO3(反应的化学方程式为NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl),然后再将NaHCO3制成Na2CO3.
碳酸钠俗称纯碱,在日常生产和生活中有着广泛的应用.某化学兴趣小组想根据所学知识模拟制备碳酸钠,方法如下:先以NaCl、NH3、CO2和水等为原料以及如图所示装置制取NaHCO3(反应的化学方程式为NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl),然后再将NaHCO3制成Na2CO3.分析 实验中,稀盐酸和碳酸钙反应生成二氧化碳,反应方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;盐酸具有挥发性,所以生成的二氧化碳中含有HCl,HCl极易溶于水,所以用水洗气;将较纯净的二氧化碳通入含氨的饱和食盐水中,发生的反应为NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,尾气中含有氨气,对环境产生污染,所以尾气要进行处理,
(1)HCl极易溶于水生成稀盐酸,二氧化碳能溶于水,但不易溶于稀盐酸中;氨气有刺激性气味,污染空气;
(2)将得到的碳酸氢钠过滤、洗涤得到较干净的碳酸氢钠,然后灼烧碳酸氢钠得到碳酸钠;
(3)根据固体质量、消耗盐酸物质的量列方程组计算二者物质的量之比.
解答 解:实验中,稀盐酸和碳酸钙反应生成二氧化碳,反应方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;盐酸具有挥发性,所以生成的二氧化碳中含有HCl,HCl极易溶于水,所以用水洗气;将较纯净的二氧化碳通入含氨的饱和食盐水中,发生的反应为NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,尾气中含有氨气,对环境产生污染,所以尾气要进行处理.
(1)HCl极易溶于水生成稀盐酸,碳酸酸性小于盐酸,虽然二氧化碳能溶于水,但不易溶于稀盐酸中;氨气有刺激性气味,污染空气,尾气中含有氨气,所以尾气要进行处理,
故答案为:除去HCl;NH3;
(2)将得到的碳酸氢钠过滤、洗涤得到较干净的碳酸氢钠,碳酸氢钠不稳定,灼烧碳酸氢钠得到碳酸钠,反应方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
故答案为:过滤;洗涤;灼烧;
(3)设NaHCO3和Na2CO3的物质的量分别是xmol、ymol,碳酸氢钠、碳酸钠分别需要盐酸物质的量为xmol、2ymol,列方程组为:$\left\{\begin{array}{l}{84x+106y=19}\\{x+2y=0.3}\end{array}\right.$,
解得:$\left\{\begin{array}{l}{x=0.1}\\{y=0.1}\end{array}\right.$,
则NaHCO3和Na2CO3的物质的量之比=0.1mol:0.1mol=1:1,
故答案为:1:1.
点评 本题考查制备实验方案设计,为高频考点,题目难度中等,试题综合性较强,涉及溶液配制、根据方程式计算、基本操作、除杂等知识点,明确实验原理、基本操作方法、物质性质即可解答,试题培养了学生的化学实验能力.


科目:高中化学 来源: 题型:解答题
 某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:
某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:| 编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 /mL | 出现蓝色时间/s |
| A | 39 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | t |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水、易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 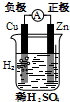 Cu-Zn原电池 | B. |  CuSO4溶液粗铜的精炼 | ||
| C. |  NnCl2溶液铁片镀锌 | D. | 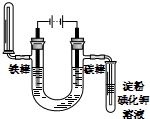 饱和NaCl溶液验证气体产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;D的最简式CH2=CH2;
;D的最简式CH2=CH2; +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$ +HBr,其反应类型为取代反应.B→C的化学方程式nCH2=CHCl$\stackrel{催化剂}{→}$
+HBr,其反应类型为取代反应.B→C的化学方程式nCH2=CHCl$\stackrel{催化剂}{→}$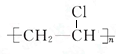 ,其反应类型为加聚反应.
,其反应类型为加聚反应.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子数为0.1NA 的N2 和NH3 混合气体,原子间含有的共用电子对数目为0.3NA | |
| B. | 2 mol SO2 和1 mol O2 在一定条件下充分反应后,所得混合气体的分子数大于2NA | |
| C. | 1.5 mol NO2 与足量水反应,转移的电子数为1.5NA | |
| D. | 常温条件下,分子数为NA 的CO、N2混合气体质量为28 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com