
| A. | 氯化氢的电子式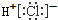 | B. | 镁的原子结构示意图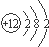 | ||
| C. | 乙酸的结构简式C2H4O2 | D. | HClO的结构式H-Cl-O |
分析 A.氯化氢为共价化合物,分子中不存在阴阳离子;
B.镁原子的核电荷数=核外电子总数=12,最外层含有2个电子;
C.乙酸分子中含有羧基,结构简式中需要标出官能团结构;
D.次氯酸的中心原子为O,分子中不存在H-Cl键.
解答 解:A.化氢为共价化合物,氯原子最外层达到8个电子稳定结构,氯化氢的电子式为 故A错误;
故A错误;
B.Mg原子的核电荷数、核外电子总数都是12,镁的原子结构示意图为: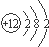 ,故B正确;
,故B正确;
C.为乙酸的分子式,乙酸的结构简式中应该标出羧基,乙酸正确的结构简式为:CH3COOH,故C错误;
D.次氯酸分子中含有1个H-O键和1个O-Cl键,其正确的结构式为:H-O-Cl,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、原子结构示意图、结构简式、结构式等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的分析能力及规范答题能力.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
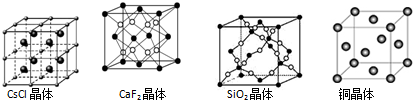
| A. | 在CsCl晶体中,距Cs+最近的Cl-有6个 | |
| B. | 在CaF2晶体中,Ca2+周围距离最近的F-有4个 | |
| C. | 在SiO2晶体中,每个晶胞中含有4个Si原子和8个O原子 | |
| D. | 在铜晶体中,每个铜原子周围距离最近的铜原子有12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
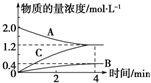 如图,曲线表示在800℃时和某反应有关的物质A、B、C的物质的量浓度从开始反应至4min时的变化图象,试回答:
如图,曲线表示在800℃时和某反应有关的物质A、B、C的物质的量浓度从开始反应至4min时的变化图象,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
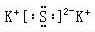 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .①②②③ | B. | ②③②① | C. | ②①②③ | D. | ①①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | 只有①③④⑤ | C. | ②③④⑤⑦ | D. | 只有①③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
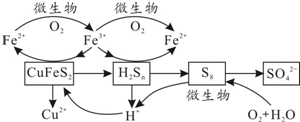
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
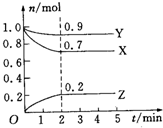 某温度时,在2L密闭容器中,X、Y、Z三种气体物质的量随时间变化的曲线如图所示,下列说法中不正确的是( )
某温度时,在2L密闭容器中,X、Y、Z三种气体物质的量随时间变化的曲线如图所示,下列说法中不正确的是( )| A. | 该反应的化学方程式为3X+Y?2Z | |
| B. | 反应到达平衡状态时,X的转化率为70% | |
| C. | 反应开始到2min,Z的平均反应速率为0.05mol•L-1•min-1 | |
| D. | 为提高X的转化率,可适当增加Y的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com