
��12�֣�ȡ����Ϊ4.6g�Ĵ����Ľ�����ƽ���ֳ����ȷݣ�������ʵ�飺
��1����һ��ֱ��Ͷ��������ˮ�У���ַ�Ӧ��õ�������A��200mL��Һ���ף���
��2����һ���ڸ������������Ⱥ�ת����3.5g���壨����������в��������Ƶĵ��ʣ����ٽ����ù���ȫ��Ͷ��������ˮ�У���ַ�Ӧ��õ�����B��200mL��Һ���ң�����
��ͬ��ͬѹ�£�����A������B���ܶ�֮��Ϊ ��
����Һ�����ʵ���Ũ�ȣ� ��
����Һ�����ʵ���Ũ�ȣ��� �ң��� ����������������������������ȷ��������
��3.5g���������ɷ��� ��
A��ֻ��Na2O B��ֻ��Na2O2
C���Ⱥ�Na2O�ֺ�Na2O2 D����ȷ��
��1�� 1:16 ��2��0.5mol��L��1 = C
��������
�����������Ͷ���ˮ�з���2Na+2H2O=2NaOH+H2�����Ƹ�����������������Na2O2���ٽ����ù���Ͷ���ˮ�з���2Na2O2��2H2O ===4NaOH��O2������ͬ��ͬѹ�£������������ܶ�֮�ȵ���Ħ������֮��Ϊ2:32=1:16���ڸ�����Ԫ���غ㣬��Һ����NaOH�����ʵ���Ϊ =0.1mol�����ʵ���Ũ�ȣ�
=0.1mol�����ʵ���Ũ�ȣ� =0.5mol��L��1��������Һ�����ʾ�ΪNaOH��������Ԫ���غ㣬����ҺŨ����ȣ���2Na��Na2O��2Na ��Na2O2��2.3g����ȫ����Ϊ����������Ϊ3.1g����ȫ������Ϊ������������Ϊ3.9g����Ϊ��������Ϊ3.5g�����ڶ���֮�䣬���Թ����мȺ�Na2O�ֺ�Na2O2��
=0.5mol��L��1��������Һ�����ʾ�ΪNaOH��������Ԫ���غ㣬����ҺŨ����ȣ���2Na��Na2O��2Na ��Na2O2��2.3g����ȫ����Ϊ����������Ϊ3.1g����ȫ������Ϊ������������Ϊ3.9g����Ϊ��������Ϊ3.5g�����ڶ���֮�䣬���Թ����мȺ�Na2O�ֺ�Na2O2��
���㣺��������Ƽ��仯��������ʡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ɽ��ʡ�߶���ѧ��1��������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
�����������У���˵��������ǿ�ᣬ�������������
A���������pH��4������ʹ���ϡ�͵�pH��5����Һ���������ӵ�ˮ����
B������ʹ��ᶼ������Ӧ�����κ�Ũ���ᷴӦ��ȡ
C��0.1mol��L��1��������Һ��pH��7
D����ͬpH������ʹ���ֱ��п��Ӧʱ��������������ʼ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ɹŰ������и߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A����һ���¶���AgClˮ��Һ�У�Ag+��Cl-Ũ�ȵij˻���һ������
B��AgCl�� Ksp = 1��8��10-10 mol2��L-2�����κκ�AgCl�������Һ�У�c(Ag+) = c(Cl-)��Ag+��Cl-Ũ�ȵij˻�����1��8��10-10 mol2��L-2
C���¶�һ��ʱ����Һ��Ag+��Cl-Ũ�ȵij˻�����Kspֵʱ������ҺΪAgCl�ı�����Һ
D����AgClˮ��Һ�м������ᣬKspֵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ɹŰ������и߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼ�ǡ����ȫ�к�ʱ,������Ӧ��( )һ�����
A������ B�����ʵ���
C�����ʵ���Ũ�� D��H+��OH-�����ʵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ɹŰ������и߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����Һ��pHΪ4,����Һ��pHΪ2,����Һ������Һ��c(H+)֮��Ϊ
A��100 B��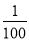 C��2 D��
C��2 D��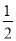
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ɽ��ʡ�ij��и�һ��ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����Al2(SO4)3��MgCl2�Ļ����Һ����������μ���NaOH��Һ���õ����������ʵ�����W�������NaOH��Һ�������ϵ��ͼ��ʾ����ԭ��Һ��SO42-��Cl-�����ʵ���֮��Ϊ
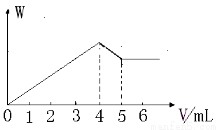
A��1:1 B��3:2 C��2:3 D��2:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ɽ��ʡ�ij��и�һ��ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ʷ������ȷ�����
�� | �� | ���������� | �� | |
A. | H2CO3 | ���� | CaO | ���� |
B. | H2SO4 | �ռ� | Na2O | С�մ� |
C. | HNO3 | ��ˮ | Al2O3 | ʯ��ʯ |
D. | NaHCO3 | ��ʯ�� | Al(OH)3 | ʳ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�����и�һ��ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
����ijЩ���ӵļ��鼰����һ����ȷ����
A������ϡ���������ɫ��ζ���壬������ͨ�����ʯ��ˮ�У���Һ����ǣ�һ����CO32?
B�������Ȼ�����Һ�а�ɫ�����������ټ����ᣬ��������ʧ��һ����SO42?
C��������ˮ���ټ���KSCN��Һ����Һ���ɫ��һ����Fe2+
D����������������Һ�����ȣ�������������ʹʪ���ɫʯ����ֽ������һ����NH4+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�����и߶���ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪������п��صĵ缫��Ӧ��пƬ��Zn��2OH����2e�� �� ZnO �� H2O��
ʯī��1/2 O2��H2O ��2e�� �� 2OH��,�ݴ��ƶ�пƬ��
A.������������ B.����������ԭ C.������������ D.����������ԭ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com