
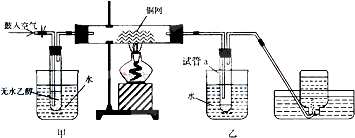
分析 实验室探究乙醇的催化氧化反应,可将甲进行水浴加热,能使甲中乙醇平稳气化成乙醇蒸气,则进入铜网的气体为空气和乙醇的混合气体,在加热条件下,分别发生2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O,可观察到铜网出现红色和黑色交替的现象,进入乙中的气体经冷却后,可在试管中得到乙醛、乙醇和水,而集气瓶中收集的气体主要为氮气,a试管中生成乙醛,含有醛基,可与银氨溶液发生银镜反应,以此解答该题.
解答 解:(1)进入乙中的气体为空气和乙醇,加热时,铜和氧气反应生成氧化铜,方程式为2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,氧化铜和乙醇在加热条件下发生氧化还原反应可生成乙醛和铜,反应的方程式为CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O,
故答案为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O;
(2)乙醇受热容易挥发,甲的作用是让乙醇以蒸汽的形式出来,乙酸在16.6℃是以晶体形式存在,所以乙的作用是将混合物冷却,空气中的氧气反应,所以最后收集的其他主要为氮气,
故答案为:加热;冷却;氮气;
(3)乙酸能使紫色石蕊试纸显红色,醋酸具有酸的通性,可以用碳酸氢钠来检验醋酸的存在,看是否产生无色无味的气体物质,两种互溶物质的分离可以采用蒸馏法,
故答案为:乙酸;c;蒸馏;
(4)a试管中生成乙醛,含有醛基,可与银氨溶液发生银镜反应,为氧化反应,故答案为:氧化反应.
点评 本题以乙醇的催化氧化为载体综合物质的性质实验设计,综合考查学生的分析能力和实验能力,为高考常见题型,注意把握实验的原理以及操作方法,难度不大.


科目:高中化学 来源: 题型:解答题
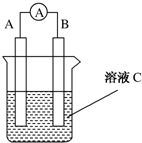 如图所示是原电池的装置图(
如图所示是原电池的装置图( 为电流表).请回答:
为电流表).请回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2>△H3 | B. | △H1<△H3<△H2 | C. | △H1=△H3>△H2 | D. | △H2=△H3<△H1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 第二周期 | ① | ② | ③ | ④ | |||
| 第三周期 | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 第四周期 | ⑨ | ⑩ |
 ,元素③和⑤形成原子个数比为1:1的化合物的电子式
,元素③和⑤形成原子个数比为1:1的化合物的电子式 ,元素②、④的气态氢化物反应后的产物的电子式
,元素②、④的气态氢化物反应后的产物的电子式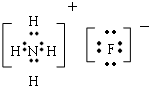 .
. .
.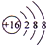 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
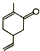
| A. | Y的化学式为C9H10O | |
| B. | Y可以发生加成反应和银镜反应 | |
| C. | Y分子中最多有7个碳原子处于同一平面 | |
| D. | Y的同分异构体中,属于芳香烃化合物、且苯环上仅含有一个侧链的醇类物质有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
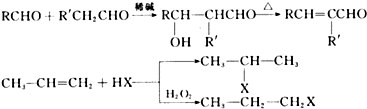


 .W有多种同分异构体,其中:①分子中有苯环,且苯环上的一溴代物有两种;②其水溶液遇FeCl3溶液呈紫色.则其可能的结构简式为(写两种):
.W有多种同分异构体,其中:①分子中有苯环,且苯环上的一溴代物有两种;②其水溶液遇FeCl3溶液呈紫色.则其可能的结构简式为(写两种): 、
、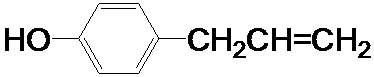
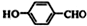 为原料制取液晶材料的中间体
为原料制取液晶材料的中间体  的合成路线图.
的合成路线图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com