
 如图所示进行实验:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2.已知集气瓶的容积为150mL.氧气的密度为1.4g/L,为了节约药品.理论上所取硫的质量不能超过多少克?(要写过程,计算结果保留两位小数)
如图所示进行实验:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2.已知集气瓶的容积为150mL.氧气的密度为1.4g/L,为了节约药品.理论上所取硫的质量不能超过多少克?(要写过程,计算结果保留两位小数) 分析 氧气的质量为(0.15-0.02 L)×1.4g/L=0.18g,结合S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2计算需要的S,以此来解答.
解答 解:氧气的质量(0.15-0.02 L)×1.4g/L=0.18g,
设所取硫的质量最多为x,
S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2
32 32
x 0.18g
$\frac{32}{32}$=$\frac{x}{0.18g}$
x=0.18 g,
答:理论上所取硫的质量不能超过0.18g.
点评 本题考查化学反应的计算,为高频考点,把握发生的反应及质量关系为解答的关键,侧重分析与计算能力的考查,注意氧气的质量计算,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 不能发生丁达尔效应的分散系有氯化钠溶液、水等 | |
| B. | 将1 L 2 mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA | |
| C. | 黄河入海口处三角洲的形成与胶体性质有关 | |
| D. | 电泳现象说明胶体带电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
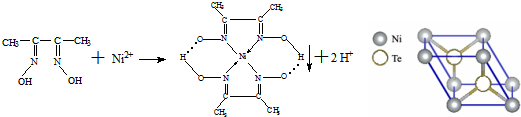
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
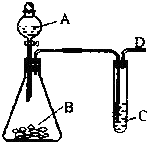 某同学用如图所示的装置来探究SO2的性质及有关实验.
某同学用如图所示的装置来探究SO2的性质及有关实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
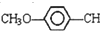 =CHCOOCH2CH2CH(CH3)2合成路线如下:
=CHCOOCH2CH2CH(CH3)2合成路线如下: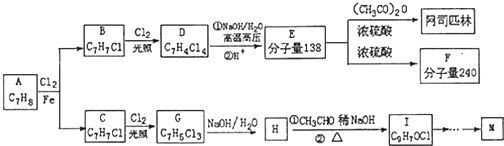
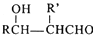 $\stackrel{△}{→}$RCH═
$\stackrel{△}{→}$RCH═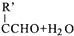
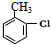 ,H→I两步反应的反应类型加成反应、消去反应
,H→I两步反应的反应类型加成反应、消去反应
 任意1种.
任意1种.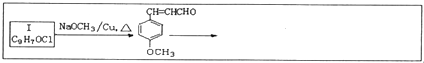
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| 0.01mol/LKIO3酸性溶液 (含淀粉)的体积/mL | 0.01mol/L Na2SO3溶液 的体积/mL | H2O 的体积 /mL | 实验温 度/℃ | 溶液出现 蓝色时所 需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 跟金属钠反应 | |
| B. | 在足量氧气中完全燃烧生成CO2和H2O | |
| C. | 在浓硫酸存在时和乙酸发生酯化反应,生成乙酸乙酯和水 | |
| D. | 当银或铜存在时跟O2发生反应,生成乙醛和水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com