
 ��֪A��B��C��D���ֶ�����Ԫ�أ����ǵĺ˵������������Aԭ�ӣ�Cԭ�ӵ�L�ܲ��У���������δ�ɶԵĵ��ӣ�C��Dͬ���壮 E��F���ǵ�������Ԫ�أ�Eԭ�Ӻ�����4��δ�ɶԵ��ӣ�Fԭ�ӳ������ܲ�ֻ��1�������⣬������ܲ��Ϊȫ����������������Ϣ��գ�
��֪A��B��C��D���ֶ�����Ԫ�أ����ǵĺ˵������������Aԭ�ӣ�Cԭ�ӵ�L�ܲ��У���������δ�ɶԵĵ��ӣ�C��Dͬ���壮 E��F���ǵ�������Ԫ�أ�Eԭ�Ӻ�����4��δ�ɶԵ��ӣ�Fԭ�ӳ������ܲ�ֻ��1�������⣬������ܲ��Ϊȫ����������������Ϣ��գ� ��Fԭ�ӵĵ����Ų�ʽ��1s22s22p63s23p63d104s1��
��Fԭ�ӵĵ����Ų�ʽ��1s22s22p63s23p63d104s1�� ��
������ A��B��C��D���ֶ�����Ԫ�أ����ǵĺ˵������������Aԭ�ӡ�Cԭ�ӵ�L�ܲ��ж�������δ�ɶԵĵ��ӣ���Aԭ�Ӻ�������Ų�Ϊ1s22s22p2��Cԭ�Ӻ�������Ų�Ϊ1s22s22p4����AΪ̼Ԫ�ء�CΪ��Ԫ�أ�Bԭ����������C��O֮�䣬��BΪ��Ԫ�أ�C��Dͬ���壬��DΪSԪ�أ�E��F���ǵ�������Ԫ�أ�Eԭ�Ӻ�����4��δ�ɶԵ��ӣ�ԭ�Ӻ�������Ų�Ϊ1s22s22p63s23p63d64s2����EΪFe��Fԭ�ӳ������ܲ�ֻ��1�������⣬������ܲ��Ϊȫ������Fԭ�Ӻ��������=2+8+18+1=29����FΪCuԪ�أ��ݴ˽��
��� �⣺A��B��C��D���ֶ�����Ԫ�أ����ǵĺ˵������������Aԭ�ӡ�Cԭ�ӵ�L�ܲ��ж�������δ�ɶԵĵ��ӣ���Aԭ�Ӻ�������Ų�Ϊ1s22s22p2��Cԭ�Ӻ�������Ų�Ϊ1s22s22p4����AΪ̼Ԫ�ء�CΪ��Ԫ�أ�Bԭ����������C��O֮�䣬��BΪ��Ԫ�أ�C��Dͬ���壬��DΪSԪ�أ�E��F���ǵ�������Ԫ�أ�Eԭ�Ӻ�����4��δ�ɶԵ��ӣ�ԭ�Ӻ�������Ų�Ϊ1s22s22p63s23p63d64s2����EΪFe��Fԭ�ӳ������ܲ�ֻ��1�������⣬������ܲ��Ϊȫ������Fԭ�Ӻ��������=2+8+18+1=29����FΪCuԪ�أ�
��1����̬Sԭ���е���ռ�ݵ�����ܲ�Ϊ��3�ܲ㣬����M�����ܲ���1��s�����3��p�����5��d���������9 ��ԭ�ӹ�����ʴ�Ϊ��M��9��
��2��Fe2+���ӵļ۲�����Ų�3d6����۲�����Ų�ͼ�� ��FΪCuԪ�أ�ԭ�Ӻ�����29�����ӣ�ԭ�ӵĵ����Ų�ʽ��1s22s22p63s23p63d104s1���ʴ�Ϊ��
��FΪCuԪ�أ�ԭ�Ӻ�����29�����ӣ�ԭ�ӵĵ����Ų�ʽ��1s22s22p63s23p63d104s1���ʴ�Ϊ�� ��1s22s22p63s23p63d104s1��
��1s22s22p63s23p63d104s1��
��3��̼Ԫ�ص�����������Ӧ��ˮ����ΪH2CO3�����ӽṹʽΪ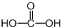 ������Cԭ�ӳ�3���Ҽ���û�йµ��Ӷԣ�Cԭ�Ӳ�ȡsp2�ӻ���ʽ��B����̬�⻯��ΪNH3��VSEPRģ��Ϊ�����壬�ʴ�Ϊ��sp2�������壻
������Cԭ�ӳ�3���Ҽ���û�йµ��Ӷԣ�Cԭ�Ӳ�ȡsp2�ӻ���ʽ��B����̬�⻯��ΪNH3��VSEPRģ��Ϊ�����壬�ʴ�Ϊ��sp2�������壻
��4��������CO2��N2O��������SCN-��Ϊ�ȵ����壬���ǽṹ���ƣ�SCN-��Cԭ����S��Nԭ��֮���γ�2�Թ��õ��Ӷԣ�SCN-�ĵ���ʽΪ ��
��
�ʴ�Ϊ�� ��
��
��5����������ɫ��Ӧ����ɫ������KԪ�أ����ڽ�����������Fe3+����λ��CN-���ɣ���λ��Ϊ6����ΪK3[Fe��CN��6]����ˮ��Һ��������ʵ������Fe2+���ӵĶ��Լ��飬����Fe2+���ӵ����ӷ���ʽΪ��3Fe2++2[Fe��CN��6]3-=Fe3[Fe��CN��6]2����
�ʴ�Ϊ��3Fe2++2[Fe��CN��6]3-=Fe3[Fe��CN��6]2����
��6��������D��S��ԭ��λ�ھ����ڲ���ԭ����ĿΪ8����E��Fe��ԭ��6��λ�����ϡ�4��λ�����ϣ�E��Fe��ԭ����Ŀ=6��$\frac{1}{2}$+4��$\frac{1}{4}$=4��F��Cu��ԭ��λ��4��λ�����ϡ�1���ڲ���8�������ϣ�ԭ����Ŀ=4��$\frac{1}{2}$+1+8��$\frac{1}{8}$=4��������Cu��Fe��Sԭ����Ŀ֮��=4��4��8=1��1��2���ʸþ��廯ѧʽΪ��CuFeS2��
��������=$\frac{��56+64+32��2��g/mol}{6.02��1{0}^{23}mo{l}^{-1}}$��4���������=��524��10-10 cm��2��103��10-10 cm��
�þ�����ܶ�d=��$\frac{��56+64+32��2��g/mol}{6.02��1{0}^{23}mo{l}^{-1}}$��4����[��524��10-10 cm��2��103��10-10 cm]=4.32g/cm3��
�ʴ�Ϊ��CuFeS2��4.32��
���� �����ǶԿ������ʽṹ�Ŀ��飬�漰��������Ų����ӻ����ۡ��ȵ����塢������������ȣ���Ҫѧ���߱���ʵ�Ļ�������5��Ϊ�״��㡢�ѵ㣬��Ҫѧ���߱�һ���Ŀռ���������ѧ�����������Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ���ش��������⣺
���ش��������⣺ $\stackrel{һ��������}{��}$
$\stackrel{һ��������}{��}$ +2H2O��
+2H2O�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��C�����������ŵ��������Ȼ�����ԭ�ӣ�
��C�����������ŵ��������Ȼ�����ԭ�ӣ� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ����ϡ����ķ�Ӧ���ϸ�ͼʾ | B�� | �÷�ӦΪ���ȷ�Ӧ | ||
| C�� | A������һ������C������ | D�� | �÷�Ӧֻ���ڼ��������²��ܽ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������Ϊ20����ԭ�ӣ�${\;}_{17}^{20}$Cl | |
| B�� | ���Ľṹ��ʽ��C6H6 | |
| C�� | H2CO3�ĵ��뷽��ʽ��H2CO3?2H++CO32- | |
| D�� | �������ƣ�CaO2���ĵ���ʽ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Al2��SO4��3��Һ�μӰ�ˮ������ɫ��״������Al3++3OH-�TAl��OH��3�� | |
| B�� | ̼������Һ�����̪��죺CO32-+2H2O?H2CO3+2OH- | |
| C�� | ������������Һ����μ�������̼��������Һ��Ba2++2OH-+2HCO3-�TBaCO3��+2H2O+CO32- | |
| D�� | ��������Һ�еμ�����HI��Һ��Fe3++3NO3-+12H++10I-�TFe2++5I2+3NO��+6H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ʯīϩ��һ���л��� | B�� | ʯīϩ��̼ԭ�Ӽ��Թ��ۼ���� | ||
| C�� | ʯīϩ���к���ϩ��ͬ������ | D�� | 12gʯīϩ��Լ��6.02��1023��e- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1.204��1024 | B�� | 0.5 | C�� | 6.02��1023 | D�� | 3.01��1023 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com