

分析 装置A中的分液漏斗中的浓硫酸滴入锥形瓶中反应生成二氧化硫气体,通过装置B为安全瓶,通过装置C中的氯化铁溶液具有氧化性能氧化二氧化硫为硫酸,氯化铁被还原为氯化亚铁,最后过量的二氧化硫被氢氧化钠溶液吸收,
(1)配制氯化铁溶液时,应加相应的酸抑制铁离子水解,在烧杯中稀释配制溶液;
(2)通入足量SO2时C中发生二氧化硫与氯化铁的氧化还原反应,生成硫酸亚铁;
(3)①发生氧化还原反应,生成硫酸根离子、亚铁离子;
②检验有Fe2+生成,利用KSCN和氯水,先不变红,后变红分析;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,硝酸具有强氧化性;
(4)倒置漏斗可防止NaOH溶液倒吸;
(5)验证SO2具有还原性,选择与二氧化硫反应的具有强氧化性的物质.
解答 解:(1)配制氯化铁溶液时,需先把氯化铁晶体溶解在浓盐酸中,再加水稀释,这样操作的目的是抑制铁离子水解,操作中需要用药匙取固体在烧杯中进行溶解,用利用璃棒不断搅拌,不需要的仪器有c、e,
故答案为:浓盐酸;抑制氯化铁水解;c、e;
(2)通入足量SO2时C中发生二氧化硫与氯化铁的氧化还原反应,生成硫酸亚铁,则观察到溶液由棕黄色变为浅绿色,
故答案为:溶液由棕黄色变为浅绿色;
(3)①发生氧化还原反应,生成硫酸根离子、亚铁离子,离子反应为2Fe3++SO2+2H2O=SO42-+4H++2Fe2+,
故答案为:2Fe3++SO2+2H2O=SO42-+4H++2Fe2+;
②检验有Fe2+生成的实验方法为取C中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶液变红,
故答案为:取C中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶液变红;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,硝酸具有强氧化性,则硝酸可以将溶解的SO2氧化为 H2SO4,干扰试验,故做法不合理,
故答案为:不合理;硝酸可以将溶解的SO2氧化为 H2SO4,干扰试验;
(4)因尾气易溶于NaOH溶液,则倒置漏斗的作用为防止NaOH溶液倒吸,
故答案为:使气体充分吸收,防止溶液倒吸;
(5)验证SO2具有还原性,可与高锰酸钾或碘水发生氧化还原反应,S元素的化合价升高,而与浓硫酸、NaCl不反应,
故答案为:b、c.
点评 本题考查性质实验方案的设计及实验装置综合,为高频考点,把握装置中发生的反应及氧化还原反应原理的应用为解答的关键,侧重分析与实验能力的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

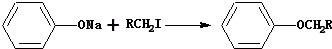
 .
.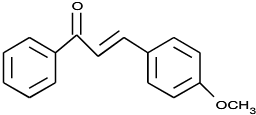 .
.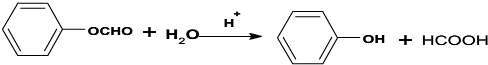 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中能量变化的大小与反应物的多少无关 | |
| B. | 化学反应必然伴随能量的变化 | |
| C. | 化学反应中能量的主要是由化学键变化引起的 | |
| D. | 能量变化是化学反应的基本特征之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,1 mol•L-1醋酸溶液与0.5 mol•L-1醋酸溶液中,c(H+)之比是2:1 | |
| B. | 向醋酸钠溶液中加入适量醋酸,使混合液的pH=7,此时混合液中c(Na+)=c(CH3COO-) | |
| C. | 保存FeSO4溶液时,应在其中加入稀HNO3以抑制Fe2+水解 | |
| D. | 0.1 mol•L-1NH4Cl溶液中c(NH4+)+c(H+)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com