
下列离子能在溶液中大量共存的是( )
A.Na+、NH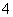 、CO
、CO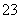 、Br-
、Br-
B.Fe2+、H+、NO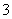 、Cl-
、Cl-
C.Al3+、Ca2+、HCO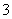 、SO
、SO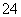
D.Fe3+、Cu2+、NO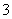 、OH-
、OH-
科目:高中化学 来源: 题型:
已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ·mol-1,下列说法正确的是( )
A.2 L氟化氢气体分解成1 L氢气与1 L氟气吸收270 kJ热量
B.1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ
C.在相同条件下,1 mol氢气与1 mol氟气的能量总和大于2 mol氟化氢气体的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物键线式结构的特点是以线示键,每个折点和线端处表示有一个碳原子,并以氢补足四键,C、H不表示出来,其它原子或原子团要表示出来,例如:CH3CHOHCH3的键线式结构为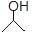 。 CH3CH=CHCH3是石油裂解的产物之一,它的键线式结构可表示为
。 CH3CH=CHCH3是石油裂解的产物之一,它的键线式结构可表示为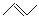 。
。
⑴CH3CH=CHCH3的名称为 ,其所含官能团的结构式为 ,与H2在一定条件下发生加成反应,其产物的同分异构体的键线式结构为 。
⑵完成下列反应方程式,产物用键线式表示: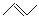 +Br2→ ,反应类型为 反应。
+Br2→ ,反应类型为 反应。
⑶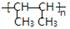 是一种加聚产物,则其单体的结构简式为 ,其链节为
是一种加聚产物,则其单体的结构简式为 ,其链节为
。
⑷写出与CH3CH=CHCH3含有相同官能团的同分异构体的结构简式
。(任写一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
完成下列离子方程式:
(1)钠与水反应:_______________________________________________________________。
(2)氯气通入水中:_____________________________________________________________。
(3)向氢氧化钠溶液中通入少量CO2:
________________________________________________________________________。
(4)碳酸钙中滴入醋酸溶液:
________________________________________________________________________。
(5)铝片投入氢氧化钠溶液:
________________________________________________________________________。
(6)氯化铝溶液中加足量碳酸氢钠溶液:
________________________________________________________________________。
(7)FeCl3溶液与Cu反应:
________________________________________________________________________。
(8)酸性硫酸亚铁溶液中加入过氧化氢溶液:
________________________________________________________________________。
(9)实验室用MnO2与浓盐酸制取Cl2:
________________________________________________________________________。
(10)NO2溶于水:_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子在指定的溶液中能大量共存的一组是( )
A.加入甲基橙显红色的溶液中:Mg2+、Fe2+、Cl-、NO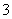
B.pH=12的无色透明溶液中:Mg2+、SO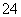 、NO
、NO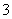 、K+
、K+
C.无色透明溶液中:SO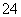 、NO
、NO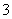 、Na+、Fe3+
、Na+、Fe3+
D.澄清透明溶液中:Cu2+、SO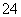 、K+、Br-
、K+、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式书写正确的是(双选)( )
A.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH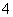
B.将Fe(OH)2溶于过量的稀硝酸:Fe(OH)2+2H+===Fe2++2H2O
C.用NaClO溶液吸收过量的SO2:ClO-+SO2+H2O===SO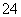 +Cl-+2H+
+Cl-+2H+
D.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+===Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是( )
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化
B.破坏反应产物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,反应为吸热反应
C.反应产物的总焓大于反应物的总焓时,反应吸热,ΔH>0
D.ΔH的大小与热化学方程式的计量系数无关
查看答案和解析>>
科目:高中化学 来源: 题型:
10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为:该溶液pH升高的原因是HCO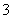 的水解程度增大,碱性增强。
的水解程度增大,碱性增强。
乙同学认为:该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________NaHCO3的水解程度(填“大于”或“小于”)。
丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)的判断正确。试剂X是________。
A.Ba(OH)2溶液 B.BaCl2溶液 C. NaOH溶液 D.澄清石灰水
(2)将加热煮沸后的溶液冷却到10 ℃,若溶液的pH________8.3(填“高于”、“低于”或“等于”),则甲判断正确。
(3)查阅资料,发现NaHCO3固体的分解温度为150 ℃,丙断言________(填“甲”或“乙”)判断是错误的,理由是_______________________________________________________________。
(4)关于NaHCO3饱和水溶液的表述正确的是_______________________。
a.c(Na+)=c(HCO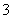 )+c(CO
)+c(CO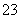 )+c(H2CO3)
)+c(H2CO3)
b.c(Na+)+c(H+)=c(HCO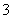 )+c(CO
)+c(CO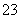 )+c(OH-)
)+c(OH-)
c.HCO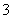 的电离程度大于HCO
的电离程度大于HCO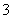 的水解程度
的水解程度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com