
【题目】乙二酸(H2C2O4)俗称草酸,在实验研究和化学工业中应用广泛。草酸溶液中各粒子的物质的量分数随溶液pH变化关系如下图,下列说法正确的是
已知:①室温下,0.1 mol· L-1 H2C2O4的pH=1.3 ;0.1 mol· L-1NaHC2O4的pH=2.8
②草酸钙(Ca C2O4)难溶于水;
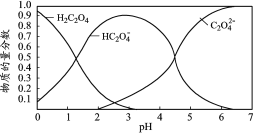
A.pH=4.5的草酸溶液中含有的大量微粒有:H2C2O4、HC2O4-、C2O42-
B.0.1 mol·L1 NaHC2O4溶液中:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)
C.向H2C2O4溶液中加入酸性高锰酸钾溶液,紫色褪去:2MnO4-+5C2O42-+16H+=2Mn2+ +10CO2↑ +8H2O
D.向NaHC2O4溶液中加入足量澄清石灰水,产生白色沉淀:2HC2O4- +Ca2++2OH-=Ca C2O4↓ +2H2O+C2O42-
【答案】B
【解析】
A. pH=4.5的草酸溶液中含有的大量微粒有:HC2O4-、C2O42-,A错误;
B. NaHC2O4是强碱弱酸盐,产生Na+、HC2O4-,HC2O4-既发生电离作用产生C2O42-和H+,也发生水解作用产生H2C2O4、OH-,0.1 mol·L1 NaHC2O4溶液pH=2.8,说明其电离作用大于水解作用,所以c(C2O42-)>c(H2C2O4),电离、水解消耗HC2O4-,则c(Na+)>c(HC2O4-),但主要以盐电离产生的离子形式存在,c(HC2O4-)>c(C2O42-)>c(H2C2O4),故溶液中各种微粒浓度大小关系为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4),B正确;
C. 草酸是二元弱酸,主要以酸分子存在,应该写化学式,C错误;
D. 向NaHC2O4溶液中加入足量澄清石灰水,溶液中含有大量Ca2+,反应产生草酸钙白色沉淀,不可能还存在C2O42-,D错误;
故合理选项是B。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法正确的是 ( )
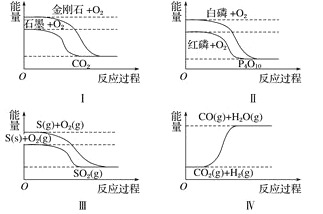
A.金刚石比石墨稳定
B.红磷转变为白磷是吸热反应
C.S(g)+O2(g) === SO2(g) ΔH1 ;S(s)+O2(g) === SO2(g) ΔH2,则ΔH1>ΔH2
D.CO(g)+H2O(g) === CO2(g)+H2(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学向100mL NH4Al(SO4)2溶液中加入0.1 mol·L-1NaOH溶液,产生沉淀的图像如下:
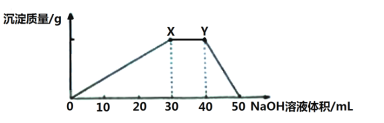
下列说法不正确的是
A.NH4Al(SO4)2溶液中含0.003 mol Al3+
B.NH4Al(SO4)2溶液中NH4+的浓度是0.01 mol·L-1
C.Al3+结合OH-的能力比NH4+强
D.Y点之后发生反应的离子方程式是:Al(OH)3+ OH-= AlO2-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
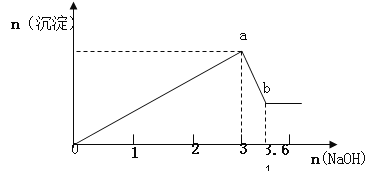
【题目】现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图,请计算出FeCl3、AlCl3的物质的量浓度各为_____ ______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核酸检测对防疫新冠肺炎意义重大。下图1是脱氧核糖核酸(DNA)的结构片段,它的碱基中胞嘧啶的结构如图2,下列说法正确的是
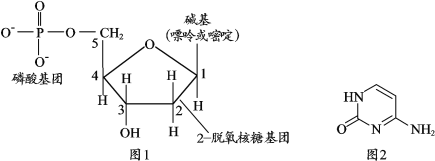
A.脱氧核糖核酸中含有的化学键都是不同原子形成的极性共价键
B.2-脱氧核糖(C5H10O4)与葡萄糖属于同系物,都能发生银镜反应
C.胞嘧啶分子式为C4H5N3O,含有的官能团是氨基和肽键
D.脱氧核糖核酸由磷酸、2-脱氧核糖和碱基通过一定方式结合而成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在金属活动性顺序里,位于氢后面的金属Cu,在常温下虽然不能与稀盐酸、稀硫酸反应,但可以与稀硝酸反应,其化学方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。在3.84gCu中加入100mL稀HNO3溶液,如恰好完全反应,计算生成NO在标准状况下的体积和反应前稀HNO3溶液中溶质的物质的量浓度___、___(请写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关Na2CO3和NaHCO3的叙述中正确的是( )
A.Na2CO3比NaHCO3热稳定性强
B.相同质量的Na2CO3和NaHCO3与足量盐酸作用时,产生的气体质量相同
C.相同温度下,Na2CO3的溶解度小于NaHCO3
D.物质的量浓度相同时,Na2CO3溶液的pH比NaHCO3溶液的小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)物质的量各为0.1mol钠、镁、铝单质,分别投入足量盐酸溶液中,生成相同条件下氢气的体积比为___。
(2)物质的量各为0.2mol的铝、铁、锌,分别与100ml1mol/L的硫酸溶液反应,生成相同条件下氢气的体积比为___。
(3)等质量的两份铝分别与足量的盐酸溶液和氢氧化钠溶液反应,消耗盐酸和氢氧化钠的物质的量比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是( )
A.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
B.反应①、过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.试剂X可以是氢氧化钠溶液,也可以是盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com