
| A. | 用加热的方法分离沙子和氯化铵晶体 | |
| B. | 用洁净的铂丝蘸取氯化钠溶液在无色火焰上灼烧,焰色呈黄色 | |
| C. | 胆矾受热变成白色粉末 | |
| D. | 熔融的氯化钠导电 |
科目:高中化学 来源: 题型:选择题
| A. | 20mol•(L•min)-1 | B. | 0.1mol•(L•s)-1 | C. | 0.2mol•(L•s)-1 | D. | 0.4mol•(L•min)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
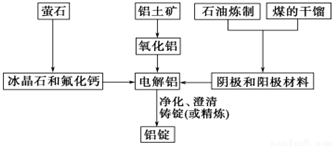
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 腐蚀电路板的反应为:Cu+2FeCl3═CuCl2+2FeCl2
腐蚀电路板的反应为:Cu+2FeCl3═CuCl2+2FeCl2查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+2NaOH═Na2CO3+H2O | B. | CO2+C(红热)═2CO | ||
| C. | CO2+Ca(OH)2═CaCO3+H2O | D. | 2Na2O2+2CO2═2Na2CO3+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜和稀硝酸反应 Cu+4H++NO3-=Cu2++2H2O+NO↑ | |
| B. | 碳酸氢钠和过量的澄清石灰水反应 2HCO3-+2OH-+Ca2+=CaCO3↓+2H2O+CO32- | |
| C. | Fe投入盐酸中 2Fe+6H+=2Fe3++3H2↑ | |
| D. | 氢氧化铝溶于氢氧化钠溶液 Al(OH)3+OH-=AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
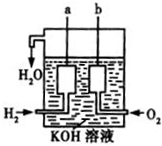 氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)═2H2O(l)△H=-572kJ/mol请回答下列问题:
氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)═2H2O(l)△H=-572kJ/mol请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
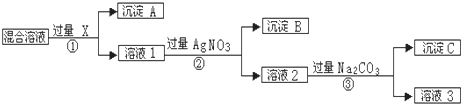
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com