


 ����ç�����������3������̼ԭ�ӣ�
����ç�����������3������̼ԭ�ӣ�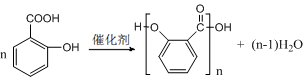 ��
�� ���� ��1��ͬϵ��ָ�ṹ���ơ�ͨʽ��ͬ����������1���������ɸ�CH2ԭ���ŵĻ������������Ŀ��������ȣ�
��2��������-OH����λ�Ͷ�λ�ϵ���ԭ���ױ�ȡ������Ũ����������£�������Ũ���ᷢ��������Ӧ��
��3���Ȼ�����������NaOH��Һ��Ӧ��
��4�����������ױ�����������̼ԭ���������ĸ���ͬ���ŵ�̼ԭ�ӣ�
��5��A�����к����Ȼ����ǻ����ܷ������۷�Ӧ��
��� �⣺��1��ͬϵ��ָ�ṹ���ơ�ͨʽ��ͬ����������1���������ɸ�CH2ԭ���ŵĻ������������Ŀ��������ȣ�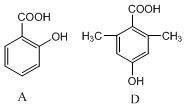 ��
��
A��D�Ľṹ��ʽ�й�������ͬ����������2��CH2ԭ���ţ���A��D��Ϊͬϵ�
�ʴ�Ϊ��AD��
��2��������-OH����λ�Ͷ�λ�ϵ���ԭ���ױ�ȡ�������Է���һ����ȡ��ʱ����Ӧ�Ŀ��ܲ����н϶�������Ǣڢܣ���C��ȷ����Ũ����������£�������Ũ���ᷢ��������Ӧ����Ӧ������Լ���ŨHNO3��ŨH2SO4��
�ʴ�Ϊ��C��ŨHNO3��ŨH2SO4��
��3���Ȼ�����������NaOH��Һ��Ӧ��Cˮ�����ɵķ��ǻ�Ҳ�����������Ʒ�Ӧ������1mol C����������NaOH��Һ��Ӧ���������3mol NaOH��
�ʴ�Ϊ��3��
��4�����������ױ�����������F�к��з��ǻ����ױ�����������̼ԭ���������ĸ���ͬ���ŵ�̼ԭ�ӣ�ç���ᣨ ����������-OH������̼ԭ�Ӷ�������̼ԭ�ӣ�������3������̼ԭ�ӣ�
����������-OH������̼ԭ�Ӷ�������̼ԭ�ӣ�������3������̼ԭ�ӣ�
�ʴ�Ϊ��F�к��з��ǻ����ױ�����3��
��5��A�����к����Ȼ����ǻ����ܷ������۷�Ӧ���䷴Ӧ����ʽΪ�� ��
��
�ʴ�Ϊ�� ��
��
���� ���⿼�����л���Ľṹ�����ʡ�ͬϵ����жϣ���Ŀ�Ѷ��еȣ������ڿ���ѧ���ķ���������Ӧ��������ע������л�������ŵ������Լ��л���������̼ԭ�ӵ��жϷ�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ���� | CH3OH | CH3OCH3 | H2O |
| Ũ��/��mol•L-1�� | 0.44 | 0.6 | 0.6 |
| A�� | a=1.64 | |
| B�� | ��ʱ����Ӧ���ʴ����淴Ӧ���� | |
| C�� | ����ʼʱ����2a mol CH3OH����ﵽƽ��ʱCH3OH��ת�������� | |
| D�� | ����������ƽ��Ħ���������ٱ仯����˵����Ӧ�Ѵﵽƽ��״̬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��� | �ı������ | ���ɵ�SO3������ |
| �� | �����¶� | ��С |
| �� | �����¶� | ���� |
| �� | ����O2��Ũ�� | ���� |
| �� | �����³���Ne | ���� |
| �� | ѹ����� | ���� |
| �� | ʹ�ô��� | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��ͼ����ʢ��ϡ������ձ��з����õ������ӵĵ缫X��Y�����·�е���������ͼ��ʾ�����ڸ�װ�õ�����˵����ȷ���ǣ�������
��ͼ����ʢ��ϡ������ձ��з����õ������ӵĵ缫X��Y�����·�е���������ͼ��ʾ�����ڸ�װ�õ�����˵����ȷ���ǣ�������| A�� | X Ϊ�õ�ص����� | |
| B�� | �����缫�ֱ�Ϊͭ��п����XΪͭ��YΪп | |
| C�� | X���Ϸ������ǻ�ԭ��Ӧ��Y���Ϸ�������������Ӧ | |
| D�� | �����缫���ǽ�������X�Ļ�ԭ��ǿ��Y |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ���ӣ�0.1mol/L�� | Cu2+ | Fe2+ | Fe3+ | �ṩ��ҩƷ��������Ҫѡ��ʹ�ã� |
| �������↑ʼ����pH | 4.7 | 7.0 | 1.9 | Cl2��NaOH��Һ��CuO��Cu |
| �������������ȫpH | 6.7 | 9.0 | 3.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| Mn��OH��2 | Fe��OH��2 | Fe��OH��3 | Cu��OH��2 | |
| ��ʼ����ʱ | 8.3 | 6.3 | 2.7 | 4.7 |
| ��ȫ����ʱ | 9.8 | 8.3 | 3.7 | 6.7 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com