
分析 (1)根据n=$\frac{m}{M}$计算KMnO4的物质的量,根据方程式计算生成氯气的物质的量,再根据V=nVm计算氯气的体积;
(2)被氧化的HCl生成氯气,根据氯原子守恒计算;
(3)根据氯原子守恒计算反应后溶液中n(Cl-),根据氯离子守恒可知n(AgCl)=n(Cl-),再根据m=nM计算.
解答 解:(1)15.8g高锰酸钾的物质的量为:$\frac{15.8g}{158g/mol}$=0.1mol,浓盐酸的物质的量为0.1L×12mol/L=1.2mol,则
2KMnO4+16HCl=2KCl+2MnCl+5Cl2↑+8H2O
2mol 16mol 5mol
0.1mol 0.8mol 0.25mol
这说明反应中浓盐酸是过量的,因此生成的氯气在标准状况下的体积为0.25mol×22.4L/mol=5.6L,
答:产生的Cl2在标准状况下的体积5.6L;
(2)被氧化的氯化氢生成了氯气,因此根据氯原子守恒可知,被氧化的氯化氢的物质的量为:0.25mol×2=0.5mol,答:被氧化HCl的物质的量为0.5mol;
(3)根据氯原子守恒可知,溶液中氯离子的物质的量=1.2mol-0.5mol=0.7mol,则根据氯原子守恒可知生成的氯化银的物质的量是0.7mol,氯化银的质量为:0.7mol×143.5g/mol=100.45g,答:生成沉淀的质量为:100.45g.
点评 本题考查根据方程式计算、氧化还原反应计算,难度不大,注意(2)(3)中利用守恒进行计算,结合计算.


科目:高中化学 来源: 题型:解答题
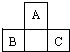 A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍,则
A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍,则 ,A的氢化物分子式为H2O;
,A的氢化物分子式为H2O;查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 实验操作 | 主要现象 | 结论或解释 |
| 步骤1:取少量固体于试管中,加入足量 ①氯化铁溶液. | 固体减少且剩余, 淡黄色溶液变浅. | 固体中含有金属铁 |
| 步骤2:分离步骤1的剩余固体于另一试管中,加入足量 ②盐酸,将反应后溶液分成甲、乙两份. | 固体全部消失. | 反应的化学方程式 ③ Fe3O4+8HCl=FeCl2+2FeCl3+H2O. |
| 步骤3:在步骤2的甲溶液中加入几滴 ④高锰酸钾溶液. | 紫红色褪去. | 溶液中含有Fe2+. |
| 步骤4:在步骤2的乙溶液中加入几滴⑤KSCN溶液. | 溶液变成红色. | 溶液中含有Fe3+. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.0 | B. | 9.5 | C. | 1 0.5 | D. | 1 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 实验目的 | 方法及操作 |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| ③ | 证明蛋白质在某些无机盐溶液作用下发生变性 | 向鸡蛋清溶液中加入饱和硫酸铜溶液,有沉淀析出;再把沉淀加入蒸馏水中 |
| ④ | 检验溴乙烷中的溴元素 | 将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液 |
| ⑤ | 判断不同反应的反应速率的大小 | 比较不同反应的反应热数据的大小 |
| A. | ①③④ | B. | ②③④ | C. | ①②④ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②④ | C. | ②③④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm互为同位素 | |
| B. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm的质量数相同 | |
| C. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm是同一种核素 | |
| D. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm的核外电子数和中子数均为62 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:丙>丁>乙 | |
| B. | 单质的还原性:丁>丙>甲 | |
| C. | 乙、丙、丁的最高价氧化物对应的水化物能相互反应 | |
| D. | 甲、乙、丙的氧化物均只有一种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com