

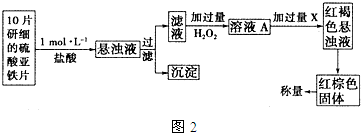
分析 (1)根据亚铁离子具有强还原性和在水溶液中易发生水解作答;
(2)①根据配制一定物质的量浓度溶液实验用到的仪器回答;
②滴定实验中,待测液放在锥形瓶中,高锰酸钾溶液具有强氧化性,放在酸式滴定管中,不用加指示剂,利用高锰酸钾溶液本身的颜色即可;
(3)10片研细的硫酸亚铁片,加入稀盐酸得到悬浊液,过滤得到滤液中加入过量过氧化氢氧化亚铁离子为铁离子,加入过量氨水溶液沉淀铁离子生成氢氧化铁沉淀,过滤得到氢氧化铁沉淀灼烧得到红棕色固体为氧化铁,
①H2O2与亚铁离子反应生成铁离子和水,以此写出离子方程式即可;
②从红褐色的悬浊液过滤得到含氢氧化铁的滤渣,洗涤除掉吸附的杂质离子,灼烧分解生成氧化铁,冷却后称量;
解答 解:(1)亚铁离子具有强还原性,容易被空气中的氧气氧化,糖衣可以隔绝空气,防止亚铁离子被氧气氧化,亚铁离子在水溶液中易水解,加盐酸增大氢离子浓度可以抑制水解,
故答案为:隔绝空气,防止被O2氧化;防止Fe2+水解;
(2)①配制一定物质的量浓度溶液实验用到的仪器除托盘天平、烧杯、玻璃棒、量筒外,还需要250mol容量瓶和定容时使用的胶头滴管,
故答案为:250ml容量瓶;胶头滴管;
②滴定实验中,待测液放在锥形瓶中,因此含硫酸亚铁的滤液放在锥形瓶,高锰酸钾溶液具有强氧化性,放在酸式滴定管中;不用加指示剂,利用高锰酸钾溶液本身的颜色即可,当加入最后一滴酸性高锰酸钾溶液时,锥形瓶中溶液的颜色变为紫色,震荡,且半分钟内不恢复原色,则滴定到了终点,
故答案为:锥形瓶;酸式滴定管;不用加;最后一滴酸性高锰酸钾溶液时,锥形瓶中溶液的颜色变为紫色,震荡,且半分钟内不恢复原色,则滴定到了终点;
(3)①H2O2与亚铁离子反应生成铁离子和水,离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
②从红褐色的悬浊液过滤得到含氢氧化铁的滤渣,洗涤除掉吸附的杂质离子,灼烧分解生成氧化铁,冷却后称量,
故答案为:A、B、F、E;
点评 本题考查亚铁离子的性质,涉及亚铁离子的强还原性、水解反应和实验仪器的选取、实验步骤的设计和滴定终点的确定,计算硫酸亚铁质量分数根据铁元素守恒计算可减少计算工作量,题目难度不大.


科目:高中化学 来源: 题型:选择题
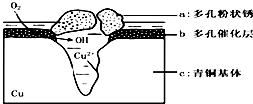 青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3 Cl.下列说法不正确的是( )
青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3 Cl.下列说法不正确的是( )| A. | 腐蚀过程中,负极b被氧化 | |
| B. | 环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ | |
| C. | 若生成 2.145gCu 2 ( OH)3 Cl,则理论上消耗标准状况氧气体积为 0.448L | |
| D. | 正极的电极反应式为:正极反应是 O2+4e-+2H2O═4OH-- |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:Z<T<X | |
| B. | R与Q的电子数相差18 | |
| C. | 气态氢化物稳定性:R<T<Q | |
| D. | 最高价氧化物对应水化物的酸性:T>Q |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;反应②的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O;
;反应②的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
| Ksp | 8.0×10-16 | 4.0×10-38 | 6.0×10-31 | 6.5×10-18 |
| 完全沉淀pH | ≥9.6 | ≥3.2 | ≥5.6 | ≥8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 | |
| B. | 为增强氯水的漂白性,可以向其中加入碳酸钙 | |
| C. | NaH与重水反应的方程式:NaH+D2O═NaOH+D2↑ | |
| D. | 均含有NA个电子的H2O和CH4具有相同的体积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com