
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:分析 (1)根据浓盐酸试剂瓶标签数据计算出1L该浓盐酸中含有氯化氢的物质的量,从而可知其物质的量浓度;
(2)盐酸溶液中,溶液浓度、溶液密度都与溶液体积大小无关,而氯化氢的物质的量、氯离子数目与溶液体积大小有关;
(3)①根据配制过程中溶质的物质的量不变计算出需要浓盐酸的体积;
②根据配制一定物质的量浓度的溶液步骤选用仪器;
③根据操作方法对c=$\frac{n}{V}$的影响分析产生的误差.
解答 解:(1)1L该浓盐酸中含有的氯化氢的质量为:$\frac{1.2×1000×36.5%}{36.5}$mol=11.9mol,该盐酸的物质的量浓度为12mol/L,故答案为:12;
(2)A.溶液中HCl的物质的量大小取决于溶液体积大小和溶液浓度,故A错误;
B.溶液具有均一性,溶液的浓度与溶液体积大小无关,故B正确;
C.溶液中Cl-的数目与溶液浓度、溶液体积大小及溶质化学式组成有关,故C错误;
D.溶液具有均一性,溶液的密度与溶液体积大小无关,故D正确;
故答案为:BD;
(3)①配制500mL物质的量浓度为0.3mol/L稀盐酸,配制过程中溶质的物质的量不变,则需要浓盐酸的体积为:$\frac{0.3mol/L×0.5L}{12mol/L}$=0.0125L=12.5mL,
故答案为:12.5;
②配制500mL物质的量浓度为0.3mol/L稀盐酸的步骤有:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,则使用的仪器有:量筒、烧杯、玻璃杯、500mL容量瓶、胶头滴管等,
故答案为:500mL容量瓶、量筒、胶头滴管;
③A.量取浓盐酸的量筒不能洗涤,否则会导致量取的浓盐酸体积偏大,配制的溶液浓度偏高,故A正确;
B.配制过程动作过慢,浓盐酸中HCl挥发,导致配制的溶液中氯化氢的物质的量偏小,配制的溶液浓度偏低,故B错误;
C.溶液注入容量瓶前没有恢复到室温就进行定容,热的溶液体积偏大,冷却后溶液体积偏小,配制的溶液浓度偏高,故C正确;
D.定容时俯视刻度线,导致加入的蒸馏水体积偏小,配制的溶液浓度偏高,故D正确;
E.定容时仰视刻度线,加入的蒸馏水体积偏大,配制的溶液浓度偏低,故E错误;
F.定容时不小心加水超过刻度线,立即用胶头滴管吸出使凹液面最低点与刻度线相切,配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故F错误;
故答案为:ACD.
点评 本题考查了配制一定物质的量浓度的溶液方法,题目难度中等,明确配制步骤为解答关键,误差分析为难点、易错点,注意根据操作方法对c=$\frac{n}{V}$的影响分析误差,试题培养了学生的化学实验能力.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{1}{1}$ | B. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{4}{1}$ | C. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{1}{4}$ | D. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{3}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
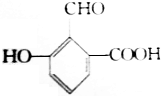 具有的三种官能团分别是:羟基、醛基和羧基,所以这种化合物可看作酚类、醛类和羧酸类.
具有的三种官能团分别是:羟基、醛基和羧基,所以这种化合物可看作酚类、醛类和羧酸类.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式):OH-、H3O+.
;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式):OH-、H3O+. Fe(OH)3+3H+△H>0,平衡正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀.
Fe(OH)3+3H+△H>0,平衡正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验某酸性溶液中Cl-和SO42-,选用试剂及顺序是过量Ba(NO3)2溶液、AgNO3溶液 | |
| B. | 将足量CO2和SO2的混合气体分别通入BaCl2溶液、Ba(NO3)2溶液中,最终都无沉淀生成 | |
| C. | 将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁 | |
| D. | 用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的有色布条 | B. | 用湿润的蓝色石蕊试纸 | ||
| C. | 将气体通入硝酸银溶液 | D. | 用湿润的淀粉碘化钾试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
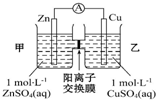
| A. | 铜电极上发生反应Cu-2e-=Cu2+ | |
| B. | 电池工作一段时间后,乙池的c(SO42- )减小 | |
| C. | 电子从锌极经过导线移向铜极 | |
| D. | 电池工作一段时间后,甲池的c(Zn2+ )增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑧ | B. | ②④⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com