
 主族元素碳、氧、氮、氟、磷、硒及副族元素镍、铜元素在化学中有很重要的地位,回答下列问题:
主族元素碳、氧、氮、氟、磷、硒及副族元素镍、铜元素在化学中有很重要的地位,回答下列问题: .
.分析 (1)基态14C原子核外电子排布为1s22s22p2,同一轨道内最多有2个自旋相反的电子,可结合洪特规则和泡利不相容原理判断;N基态原子的价电子排布式2s22p3,由此书写其价电子排布图;
(2)根据价层电子对互斥理论分析,先计算价层电子对数,再判断中心原子的杂化类型,及分子构型;
(3)利用Fe的价电子数和CO提供电子对数计算得出;根据CO的结构判断;
(4)CuSO4溶液能用作P4中毒的解毒剂,反应生成磷酸和铜;
(5)H2SeO3的分子结构为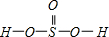 ,Se为+4价,而H2SeO4的分子结构为
,Se为+4价,而H2SeO4的分子结构为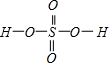 ,Se为+6价,后者Se原子吸电子能力强;
,Se为+6价,后者Se原子吸电子能力强;
(6)根据O数目和Cu2O中Cu和O的比例计算晶胞中Cu原子的数目;
(7)设铜原子半径为rcm,则晶胞的棱长2$\sqrt{2}$rcm,其体积为(2$\sqrt{2}$r)3;晶胞的质量=体积×密度;
铜的晶胞为面心立方最密堆积,一个晶胞能分摊到4个Cu原子,故铜的摩尔质量=$\frac{1}{4}$×晶胞质量×NA,据此计算Cu原子的半径;
解答 解:(1)基态14C原子核外电子排布为1s22s22p2,核外存在2对自旋相反的电子,基态N原子的价电子排布图为 ,
,
故答案为:2; ;
;
(2)OF2分子中O原子的价层电子对数=2+$\frac{1}{2}$(6-2×1)=4,则O原子的杂化类型为sp3杂化,含有2个孤电子对,所以分子的空间构型为V形;
故答案为:V形;sp3;
(3)中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,8+2n=18,n=5;CO与N2互为等电子体,所以含有一条σ键和两条π键,比值为1:2,
故答案为:5;1:2;
(4)CuSO4溶液能用作P4中毒的解毒剂,反应生成磷酸和铜,该反应的化学方程式是:P4+10CuSO4+16H2O=10Cu+4H3PO4+10H2SO4,
故答案为:P4+10CuSO4+16H2O=10Cu+4H3PO4+10H2SO4;
(5)H2SeO3的分子结构为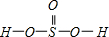 ,Se为+4价,而H2SeO4的分子结构为
,Se为+4价,而H2SeO4的分子结构为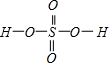 ,Se为+6价,后者Se原子吸电子能力强,导致Se-O-H中的O原子更向Se偏移,则羟基上氢原子更容易电离出H+,
,Se为+6价,后者Se原子吸电子能力强,导致Se-O-H中的O原子更向Se偏移,则羟基上氢原子更容易电离出H+,
故答案为:H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,正电性更高,导致Se-O-H中O的电子更向Se偏移,越易电离出H+;
(6)该晶胞中O原子数为4×1+6×$\frac{1}{2}$+8×$\frac{1}{8}$=8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,即为16个,
故答案为:16;
(7)设铜原子半径为rcm,则晶胞的棱长2$\sqrt{2}$rcm,其体积为(2$\sqrt{2}$r)3;铜的晶胞为面心立方最密堆积,一个晶胞能分摊到4个Cu原子,则晶胞的质量为$\frac{4×64}{{N}_{A}}$g,晶胞的质量=体积×密度;(2$\sqrt{2}$r)3=$\frac{\frac{4×64}{{N}_{A}}}{9.0}$,Cu原子的半径r=$\frac{\sqrt{2}}{4}×\root{3}{\frac{4×64}{9.00{×N}_{A}}}$cm,故答案为:$\frac{\sqrt{2}}{4}×\root{3}{\frac{4×64}{9.00{×N}_{A}}}$.
点评 本题综合考查物质的结构与性质知识,涉及电子排布图、杂化轨道、等电子体的判断及晶胞的计算等,侧重于考查学生的分析能力和对基础知识的综合应用能力,题目难度中等,注意把握含氧酸酸性强弱的判断方法.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
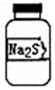 实验室现有一瓶标签右半部分已被腐蚀的固体M,剩余部分只看到“Na2S”字样(如图所示).已知固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种.若取少量固体M配成稀溶液进行下列有关实验,其中说法正确的是( )
实验室现有一瓶标签右半部分已被腐蚀的固体M,剩余部分只看到“Na2S”字样(如图所示).已知固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种.若取少量固体M配成稀溶液进行下列有关实验,其中说法正确的是( )| A. | 往溶液中通入二氧化碳,若有白色沉淀,则固体M为Na2SiO3 | |
| B. | 往溶液中加入稀盐酸酸化的BaCl2,若有白色沉淀,则固体M为Na2SO4 | |
| C. | 用pH试纸检验,若pH=7,则固体M不一定是Na2SO4 | |
| D. | 只用盐酸一种试剂不能确定该固体M的具体成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 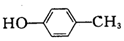 对甲苯酚 属于芳香化合物 对甲苯酚 属于芳香化合物 | B. | 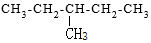 3-甲基戊烷 属于烷烃 3-甲基戊烷 属于烷烃 | ||
| C. | 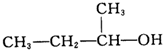 2-甲基-1-丙醇-元醇 2-甲基-1-丙醇-元醇 | D. | 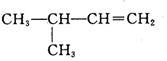 3-甲基-1-丁烯 属于脂肪烃 3-甲基-1-丁烯 属于脂肪烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
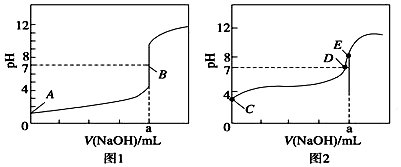
| A. | 根据图1和图2判断,滴定HBr溶液的曲线是图1 | |
| B. | a=20.00 mL | |
| C. | c(Na+)=c(CH3COO-)的点是B点 | |
| D. | E点对应溶液中离子浓度由大到小的顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 S2Cl2是工业上常用的硫化剂,已知S2C12中硫元素显+1价,它不稳定,在水中易发生岐化反应,易溶于有机溶剂.实验室常用CS2与纯净的氯气制备S2C12.反应涉及到的几种物质的熔沸点如表:
S2Cl2是工业上常用的硫化剂,已知S2C12中硫元素显+1价,它不稳定,在水中易发生岐化反应,易溶于有机溶剂.实验室常用CS2与纯净的氯气制备S2C12.反应涉及到的几种物质的熔沸点如表:| 物质 | CS2 | Cl2 | CCl4 | S2C12 |
| 沸点/℃ | 47 | -34.6℃ | 77 | 137 |
| 熔点/℃ | -109 | -100.98℃ | -23 | -77 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2$\stackrel{HCI(ap)}{→}$SiCl4$→_{高温}^{H_{2}}$Si | |
| B. | FeS2$→_{煅烧}^{O_{2}}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | N2$→_{高温、高压、催化剂}^{H_{2}}$NH3$\stackrel{HCI(ap)}{→}$NH4Cl(aq) | |
| D. | Al2O3$\stackrel{HCI(ap)}{→}$AlCl3(aq) $\stackrel{电解}{→}$ Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在 100kpa 时金刚石比石墨稳定 | |
| B. | 在 100kpa 时石墨比金刚石稳定 | |
| C. | 金刚石和石墨是碳元素的两种同位素 | |
| D. | 断裂 1mol 金刚石的化学键会放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3固体中混有A12O3:加入足量的盐酸,过滤 | |
| B. | SO2气体中混有HC1:通过饱和亚硫酸氢钠溶液 | |
| C. | FeCl2溶液中混有FeCl3:加入过量的铁粉,过滤 | |
| D. | KNO3固体中混有少量的NaCl:热水溶解、降温结晶、过滤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com