
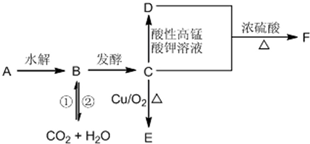
分析 A是一种遇到碘单质能变蓝的多糖,则A为淀粉,水解生成B,且二氧化碳与水可以转化生成B,应是在光合作用,故B为葡萄糖,葡萄糖发酵生成C为乙醇,乙醇在Cu作催化剂条件下氧化生成E为乙醛,乙醇被酸性高锰酸钾氧化生成D为乙酸,乙酸与乙醇发生酯化反应生成F为乙酸乙酯,据此解答.
解答 解:A是一种遇到碘单质能变蓝的多糖,则A为淀粉,水解生成B,且二氧化碳与水可以转化生成B,应是在光合作用,故B为葡萄糖,葡萄糖发酵生成C为乙醇,乙醇在Cu作催化剂条件下氧化生成E为乙醛,乙醇被酸性高锰酸钾氧化生成D为乙酸,乙酸与乙醇发生酯化反应生成F为乙酸乙酯,
(1)A是一种遇到碘单质能变蓝的多糖,A的名称是:淀粉,
故答案为:淀粉;
(2)B物质能够在加热条件下与新制的氢氧化铜反应产生砖红色沉淀,但不能发生水解反应.B的名称是葡萄糖,B中官能团的名称为:醛基、羟基,
故答案为:醛基、羟基;
(3)反应②是人体内B物质被氧化,同时又提供能量的反应.已知:1g 葡萄糖完全氧化,放出约19.2kJ的能量,则1mol 葡萄糖完全氧化将放出约$\frac{1mol×180g/mol}{1g}$×19.2kJ=3456kJ,
故答案为:3456;
(4)F是乙酸与乙醇发生酯化反应生成的乙酸乙酯,这一反应的化学方程式为:CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,C转化为E是乙醇发生氧化反应生成乙醛,反应的化学方程式:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(5)B为葡萄糖,含有醛基、羟基,C为酒精,含有羟基,D为乙酸含有羧基,
A.新制Cu(OH)2,与葡萄糖反应有红色沉淀生成,与酒精物明显现象,与乙酸反应溶解,溶液呈蓝色,可以区别三种物质,故A正确;
B.NaOH溶液与乙酸反应,现象不明显,与葡萄糖、酒精互溶,无法区别,故B错误;
C.乙酸使石蕊试液显红色,石蕊试液与葡萄糖、酒精无明显现象,不能区别,故C错误;
D.Na2CO3溶液与乙酸反应生成二氧化碳,与葡萄糖、酒精无明显现象,可以区别出乙酸,不能区别葡萄糖与酒精,故D错误,
故答案为:A.
点评 本题考查有机物推断,涉及糖类、醇、羧酸性质与转化,注意掌握官能团的性质与转化,难度中等.


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂 | |
| B. | 上述反应中每生成2molAlN,N2得到3mol电子 | |
| C. | 氮化铝中氮元素的化合价为-3 | |
| D. | 氮化铝是铝合金中的一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ | ⑨ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
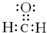 ; B的结构简式CH3CH2CHO;B的物质的量0.06mol;
; B的结构简式CH3CH2CHO;B的物质的量0.06mol;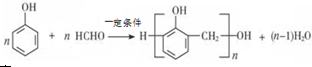 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5 mol NO2与足量的H2O反应,转移的电子数为NA | |
| B. | 常温常压下,0.5NA个CO2分子质量为22 g | |
| C. | 28 g氮气所含的原子数目为NA | |
| D. | 在标准状况下,0.5NA个氯气分子所占体积是11.2 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2015年,北京正在申办冬奥会.有一种有机物因其酷似奥林克五环旗,科学家称其为奥林匹克烃,下列有关奥匹克烃的说中正确的是( )
2015年,北京正在申办冬奥会.有一种有机物因其酷似奥林克五环旗,科学家称其为奥林匹克烃,下列有关奥匹克烃的说中正确的是( )| A. | 该物质属于苯的同系物 | |
| B. | 该物质的一氯代物有一种 | |
| C. | 该物质完全燃烧生成水的物质的量小于二氧化碳的物质的量 | |
| D. | 该物质的分子中只含有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.
已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com