
【题目】有平衡体系:CO(g)+2H2(g)![]() CH3OH(g) ΔH<0,为了增加甲醇的产量,应采取的压强措施是
CH3OH(g) ΔH<0,为了增加甲醇的产量,应采取的压强措施是
A.高温、高压B.适宜温度、高压、催化剂
C.低温、低压D.高温、高压、催化剂
【答案】B
【解析】
由CO(g)+2H2(g)![]() CH3OH(g) ΔH<0知,该反应为放热的体积缩小的可逆反应,高温将会使平衡逆向移动,不利于提高甲醇的产量,但温度太低,反应速率太慢,也不利用提高单位时间内的产量,所以温度应适当;高压能使平衡正向移动,从而提高甲醇的产量;催化剂不能改变生成物的产量,但可提高平衡前单位时间内生成物的产量。
CH3OH(g) ΔH<0知,该反应为放热的体积缩小的可逆反应,高温将会使平衡逆向移动,不利于提高甲醇的产量,但温度太低,反应速率太慢,也不利用提高单位时间内的产量,所以温度应适当;高压能使平衡正向移动,从而提高甲醇的产量;催化剂不能改变生成物的产量,但可提高平衡前单位时间内生成物的产量。
A. 高温对提高甲醇的产量不利,高压有利于提高甲醇的产量,A不合题意;
B. 适宜温度、高压、催化剂,都对提高甲醇的产量有利,B符合题意;
C. 低温、低压,都对提高甲醇的产量不利,C不合题意;
D. 高温对提高甲醇的产率不利,高压、催化剂对提高甲醇的产率有利,D不合题意;
故选B。


科目:高中化学 来源: 题型:
【题目】(1)下列各组物质中,互为同位素的是__(填序号,下同),互为同系物的是__,互为同分异构体的是__。
①红磷与白磷
②35Cl与37Cl
③CH3COOCH3与CH3CH2COOCH3
④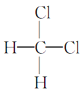 与
与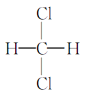
⑤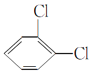 与
与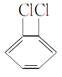
⑥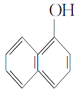 与
与
⑦乙醇与二甲醚
(2)A~D四种物质皆为烃类有机物,分子球棍模型分别如图所示,请回答下列问题。

①等物质的量的上述烃,完全燃烧时消耗O2最多的是__(填字母代号,下同),等质量的上述烃完全燃烧时消耗O2最多的是___。
②在120℃,1.01×105 Pa下,A和C分别与足量O2混合点燃,完全燃烧后气体体积没有变化的是__。
③B的某种同系物W,分子式为C6H12,且所有碳原子都在同一平面上,则W的结构简式为__。
④分子式为C5H12O的饱和一元醇有多种,不能发生催化氧化的醇分子结构简式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表前四周期的一部分,关于元素X、Y、Z的叙述错误的是

A. X的气态氢化物与Y的最高价氧化物的水化物能反应生成盐
B. 等物质的量浓度的X、Y、Z的气态氢化物的水溶液的pH:X>Y>Z
C. Z的单质常温下是液体,可与铁粉反应
D. Z的原子序数比Y大9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.反应![]() 在任何条件下都不会自发进行
在任何条件下都不会自发进行
B.溶液![]() 加水稀释后,溶液中
加水稀释后,溶液中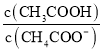 的值减小
的值减小
C.温度升高,反应物的活化分子数增多,主要因素是分子的运动加快,反应速率加快
D.![]() 液中加入少量
液中加入少量![]() 固体,
固体,![]() 水解程度减小,溶液的pH减小
水解程度减小,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组有机物,无论以何种物质的量的比例混合,只要总物质的量一定,则完全燃烧消耗氧气的量为一恒定值的是( )
A.C6H14和C7H14O3B.C2H6O和C2H4C.C5H8和C6H6D.C2H6和C3H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在实验室利用下列装置,可制备某些气体并验证其化学性质。

完成下列表格:
序号 | 气体 | 装置连接顺序(填字母) | 制备反应的化学方程式 |
(1) | 乙烯 | B→D→E | ___ |
(2) | 乙炔 | ___ | ___ |
(3)D装置中氢氧化钠溶液的作用___。
Ⅱ.工业上用乙烯和氯气为原料,经下列各步合成聚氯乙烯(PVC):
乙烯![]() 甲
甲![]() 乙
乙![]() PVC
PVC
(4)甲的结构简式是___;
(5)反应③的化学方程式是__。
(6)下列说法正确的是___。
A.乙烯可以作为植物生长调节剂
B.PVC不能使酸性高锰酸钾溶液褪色
C.PVC中的官能团是碳碳双键和氯原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结论与实验现象相符合的一组是
选项 | 实验 | 现象 | 结论 |
A | 向某盐溶液中加入浓NaOH溶液,加热 | 产生的气体能使湿润的红色石蕊试纸变蓝 | 原溶液中含有 |
B | 把SO2通入紫色的酸性高锰酸钾溶液中 | 溶液紫色褪去 | SO2具有漂白性 |
C | 向蔗糖中滴加浓硫酸 | 蔗糖变黑 | 浓硫酸具有吸水性 |
D | 向盛有Cu片的试管中加入稀H2SO4,无明显现象,再加入NaNO3固体 | Cu片逐渐溶解,产生气 泡,溶液变蓝 | NaNO3是催化剂,可增大Cu与稀H2SO4反应的化学反应速率 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别向等体积的不含O2、含有O2的0.1mol·L1BaCl2溶液中通入SO2,探究体系中物质间的相互作用,实验记录如下。(已知:pH越小,溶液酸性越强)
pH变化 |
|
溶液中是否产生沉淀 | 不含O2的BaCl2溶液中没有白色沉淀,含有O2的BaCl2溶液中产生白色沉淀。 |
下列说法不正确的是
A.a所示溶液的pH降低的原因:SO2与H2O反应生成H2SO3,溶液的c(H+)增大
B.b所示溶液中发生反应:2Ba2++O2+2SO2+2H2O=2BaSO4↓+4H+
C.b比a所示溶液的pH小的原因:Ba2++SO2+H2O=BaSO3↓+2H+
D.SO2通入不含O2的BaCl2溶液后,再通入NH3,产生BaSO3沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列电解质溶液的说法中,正确的是
A.常温下,![]() 与
与![]() 两溶液混合后
两溶液混合后![]() ,则一定有
,则一定有![]()
B.常温下,![]() 溶液与
溶液与![]() 溶液混合后所得
溶液混合后所得![]() 的溶液中:
的溶液中:![]()
C.![]() 溶液中离子总数为x,
溶液中离子总数为x,![]() 溶液中离子总数为y,则
溶液中离子总数为y,则![]()
D.已知:![]() 的
的![]() 为
为![]() ,若将浓度均为
,若将浓度均为![]() 的
的![]() 溶液和KOH溶液等体积混合,则会有
溶液和KOH溶液等体积混合,则会有![]() 沉淀产生
沉淀产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com