
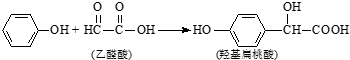
| A. | 苯酚和羟基扁桃酸互为同系物 | |
| B. | 常温下,1mol羟基扁桃酸只能与1mol Br2反应 | |
| C. | 乙醛酸的核磁共振氢谱中只有1个吸收峰 | |
| D. | 羟基扁桃酸可以发生取代、氧化、加成等反应 |
分析 A.结构相似,在分子组成上相差一个或n个-CH2原子团的有机物互称同系物;
B.羟基扁桃酸中苯环上酚羟基邻对位氢原子能被溴取代;
C.有几种氢原子,其核磁共振氢谱就有几个吸收峰;
D.羟基扁桃酸含有酚羟基、醇羟基、羧基,具有酚、醇和羧酸性质.
解答 解:A.苯酚中只含酚羟基、羟基扁桃酸中含有醇羟基、酚羟基和羧基,结构不相似,所以不是同系物,故A错误;
B.羟基扁桃酸中苯环上酚羟基邻对位氢原子能被溴取代,所以常温下,1mol羟基扁桃酸只能与2mol Br2反应,故B错误;
C.有几种氢原子,其核磁共振氢谱就有几个吸收峰,乙醛酸中含有2种氢原子,所以吸收峰有两个,故B错误;
D.羟基扁桃酸含有酚羟基、醇羟基、羧基,具有酚、醇和羧酸性质,能发生取代反应、氧化反应、加成反应、酯化反应等,故D正确;
故选D.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,注意酚发生取代反应的位置,为易错点.


科目:高中化学 来源: 题型:解答题
 3-甲基-1-丁烯.
3-甲基-1-丁烯.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; ,该化合物所含化学键为共价键;
,该化合物所含化学键为共价键;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 将饱和FeCl3溶液滴入沸水中 | 溶液变红褐色 | 有Fe(OH)3生成 |
| B | 向Na2S溶液中滴加盐酸 | 产生气泡 | Cl的非金属性比S强 |
| C | 向溶液中滴加盐酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中含有SO42- |
| D | 用导线连接铜片和锌片后插进盐酸中 | 铜片上有气泡 | 铜片是原电池的正极 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 升高温度 | B. | 加入适量的水 | ||
| C. | 加入少量CuSO4溶液 | D. | 加入浓度较大的硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们是同分异构体 | |
| B. | 它们与NaOH的醇溶液共热后产物相同 | |
| C. | 它们均属多卤代烃 | |
| D. | 它们与NaOH的水溶液都能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com