
分析 (1)用石蕊试纸检验气体的酸碱性,需先用蒸馏水湿润试纸,溶解气体;容量瓶带有玻璃塞,配制溶液前需要检验是否漏水;
(2)A.托盘天平的最小读数为0.1g;
B.高锰酸钾溶液具有氧化性;
C.瓷坩埚中二氧化硅可与碱、碳酸钠反应;
D.滴定管的“0”刻度在上端,满刻度在下端,滴定管刻度值从上到下刻度逐渐增大,滴定管满刻度以下还有一段空间没有刻度,据此即可解答;
(3)分别根据配制一定物质的量浓度的溶液、中和滴定操作方法判断使用仪器及缺少仪器;
(4)①根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析误差;
②天平的使用方法是左物右码,左盘的质量等于右盘的质量加游码的质量,即药品质量=砝码质量+游码质量,如果位置放反,根据左盘的质量=右盘的质量+游码的质量,列等式进行计算;
③根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断.
解答 解:(1)用石蕊试纸检验气体的酸碱性时,需先用蒸馏水湿润试纸,便于溶解气体,从而可测定出溶液酸碱性;
容量瓶带有玻璃塞,配制溶液前需要检验是否漏水,避免影响配制结果,
故答案为:用蒸馏水将石蕊试纸湿润;检查容量瓶是否漏水;
(2)A.托盘天平的感量为0.1g,无法用托盘天平称量5.85g氯化钠晶体,故A错误;
B.高锰酸钾溶液具有氧化性,不能用碱式滴定管量取,故B错误;
C.瓷坩埚中二氧化硅可与碱、碳酸钠反应,不能用瓷坩埚灼烧氢氧化钠、碳酸钠,故C正确;
D.滴定管的“0”刻度在上端,满刻度在下端,滴定管刻度值从上到下刻度逐渐增大,滴定管满刻度以下还有一段空间没有刻度,25mL滴定管中实际盛放液体的体积大于25mL,因此一支25mL碱式滴定管中液面恰好在10mL刻度处,把管内液体全部放出,还有满刻度以下的溶液一并放出,总量超过25-10=15mL,故D错误;
故答案为:C;
(3)①若用上述仪器配制500mL 2mol•L-1的NaCl溶液,需要的玻璃仪器有:烧杯、玻璃棒、500mL容量瓶、胶头滴管等,还缺少的玻璃仪器是:烧杯、玻璃棒、胶头滴管,
故答案为:烧杯、玻璃棒、胶头滴管;
②用上述仪器进行中和滴定,还缺少盛放待测液的锥形瓶,
故答案为:锥形瓶;
(4))①装标准液的滴定管未用标准液润洗,浓度减小,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析可知c(标准)偏大,则测得待测液的浓度偏大,故答案为:>;
②由药品的质量═左盘质量=右盘的质量+游码的质量可知:砝码质量=药品质量+游码的质量,所以药品质量=砝码质量-游码质量,即药品质量=10.0g-0.4g=9.6g,
故答案为:<;
③若定容时仰视刻度线,导致溶液的体积偏大,所以配制溶液的浓度偏低,故所得溶液浓度小于0.1mol/L,
故答案为:<.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及常见仪器的构造及使用方法、常见化学实验基本操作方法的判断及误差分析,试题知识点较多,充分考查了学生的分析、理解能力及化学实验能力.


科目:高中化学 来源:2016-2017学年安徽马鞍山二中高一10月阶段测化学卷(解析版) 题型:选择题
下列物质中,在标准状况下,体积最大的是
A.8g H2 B.48g O2 C.71g Cl2 D.1000g H2O
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三上第二次周考化学试卷(解析版) 题型:选择题
常温下,下列各组离子在有关限定条件下溶液中一定能大量共存的是
A.酸性溶液中:K+、Na+、ClO-、I-、Cl-
B.中性溶液中:K+、Fe3+ 、Cl-、CO32—、HCO3-
C.常温下,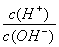 =1×10-12的溶液:K+、AlO2—、CO32—、Na+、Cl-
=1×10-12的溶液:K+、AlO2—、CO32—、Na+、Cl-
D.pH=13的溶液中:AlO2—、Cl-、HCO3—、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
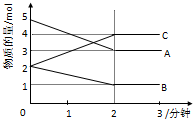 向某恒容的密闭容器中加入A、B、C三种气体,如图所示是一定条件下三种气体的物质的量随时间的变化情况.
向某恒容的密闭容器中加入A、B、C三种气体,如图所示是一定条件下三种气体的物质的量随时间的变化情况.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S?2H++S2- | B. | NaHSO4?Na ++HSO4- | ||
| C. | NaHCO3?Na++H++CO32- | D. | HCO3-?CO32-+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+ | |
| B. | 在含有等物质的量的NaOH、Ca(OH)2NaAlO2的溶液中通入CO2气体:NaOH、Ca(OH)2、NaAlO2 | |
| C. | 在含有等物质的量的H+、Al3+的溶液中,逐滴加入NaOH溶液:H+、A13+、Al(OH)3 | |
| D. | 在含有等物质的量的Fe3+、Cu2+的溶液中加入铁粉:Cu2+、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
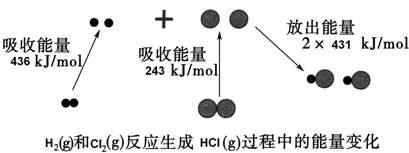
| A. | 1 mol H2(g)和1 mol Cl2(g)具有的总能量大于2 mol HCl(g)具有的总能量 | |
| B. | 该反应的△H>0 | |
| C. | 通常情况下,H2(g)和Cl2(g)混合容易直接生成HCl(g) | |
| D. | 生成的HCl溶于水会发生电离,即HCl=H++Cl-,由此判断,HCl中存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述中不正确的是( )
为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述中不正确的是( )| A. | 该物质可以视为醇类 | |
| B. | 不能使溴的四氯化碳溶液褪色,但可以使酸性的高锰酸钾溶液褪色 | |
| C. | 在浓硫酸作用下,分子内消去一个水分子,产物有两种同分异构体 | |
| D. | 该物质分子中的所有碳原子不可能共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜和稀硫酸反应:Cu+2H+=Cu2++H2↑ | |
| B. | NaHCO3溶液与HCl溶液反应:H++HCO3-=CO2↑+H2O | |
| C. | 铝和硫酸铜溶液的反应Al+Cu2+=Al3++Cu | |
| D. | 氯化铁滴入沸水中生成氢氧化铁胶体Fe3++3H2O=Fe(OH)3↓+3H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com