
下列性质的递变中,正确的是
A.O、Na、S的原子半径依次增大 B.LiOH、KOH、CsOH的碱性依次增强
C.HF、NH3、SiH4的稳定性依次增强 D.HCl、HBr、HI的还原性依次减弱
B
【解析】
试题分析:A.对于电子层数相同的微粒来说,原子序数越大,原子半径越小。因此Na>S;对于电子层数不同的元素来说,原子核外电子层数越多,原子半径就越大,所以S>O。因此原子半径大小关系是:Na>S>O。错误。B.元素的金属性:Li<K<Cs.元素的金属性越强,其对应的最高价氧化物的水化物的碱性就越强,因此减小LiOH < KOH <CsOH。正确。C.元素的非金属性F>N>Si。元素的非金属性越强,其对应的简单的氢化物的稳定性就越强,因此稳定性:HF>NH3>SiH4。错误。D.元素的非金属性越强,其对应的简单氢化物的还原性就越弱。由于非金属性:Cl>Br>I。所以还原性:HI> HBr> HCl。错误。
考点:考查同一周期、同一主族的元素的性质递变规律的知识。


科目:高中化学 来源:2013-2014湖南省岳阳市高三教学质量检测二理综化学试卷(解析版) 题型:选择题
化学与环境、科学、技术密切相关。下列有关说法中正确的是
A.煤经过气化和液化等物理变化可以转化为清洁燃料
B.在海轮外壳上镶入锡块,可减缓船体的腐蚀速率
C.光化学烟雾的形成与汽车尾气中的氮氧化物有关
D.“鸟巢”使用钒氮合金钢,该合金熔点、硬度和强度均比纯铁高
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南师大附中第二学期期中考试高二化学试卷(解析版) 题型:选择题
卤代烃的取代反应,实质是带负电荷的原子团取代了卤代烃中的卤原子,如CH3Br+OH-(或NaOH)―→CH3OH+Br-(或NaBr),下列反应的化学方程式中,不正确的是
A.CH3CH2Br+NaHS―→CH3CH2SH+NaBr
B.CH3I+CH3ONa―→CH3OCH3+NaI
C.CH3CH2Cl+CH3ONa―→CH3CH2ONa+CH3Cl
D.CH3CH2Cl+CH3CH2ONa―→(CH3CH2)2O+NaCl
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南师大附中第二学期期中考试高一化学试卷(解析版) 题型:填空题
(11分)在第3周期中,置换酸中氢的能力最强的元素的元素符号为 ,化学性质最稳定的元素符号是 ,最高价氧化物的水化物的酸性最强的化合物的化学式是 ,最高价氧化物的水化物的碱性最强的化合物的化学式是 ,显两性的氢氧化物的化学式是 ,该两性氢氧化物与盐酸、氢氧钠溶液分别反应的离子方程式为 、 ,原子半径最大的金属元素的名称是 ,离子半径最小的离子结构示意图是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南师大附中第二学期期中考试高一化学试卷(解析版) 题型:选择题
下列反应中,属于吸热反应的是
A.活泼金属跟酸反应 B.煤气燃烧 C.酸碱中和反应 D.工业制生石灰
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省黄石市秋季高二化学期中统考试卷(解析版) 题型:填空题
(17分)X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为 、 ;
(2)XZ2与YZ2分子的杂化轨道分别是 、 ,立体结构分别是 、 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 ;
(3)Q的元素符号是 ,它属于第 周期,它的核外电子排布式为 ,在形成化合物时它的最高化合价为 ;
(4)用氢键表示式 写出E的氢化物溶液中存在的所有氢键_______________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省黄石市秋季高二化学期中统考试卷(解析版) 题型:选择题
下图甲池和乙池中的四个电极都是惰性材料,乙池溶液分层,上层溶液为盐溶液,呈中性。请根据图示判断下列有关说法不正确的是( )

A.甲池是原电池、乙池是电解池
B.通入乙醇的惰性电极的电极反应式为:C2H5OH+16OH--12e-=2CO32-+11H2O
C.反应一段时间后,两池溶液的pH均未变化
D.假如乙池中加入NaI溶液,则在乙池反应过程中,可以观察到C电极周围的溶液呈现棕黄色,反应完毕后,用玻璃棒搅拌溶液,则下层溶液呈现紫红色,上层接近无色
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高三5月模拟考试理综化学试卷(解析版) 题型:填空题
(14分)(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示:

则NO2氧化SO2的热化学方程式为_________________________________。
(2)在2L密闭容器中放入1mol氨气,在一定温度进行如下反应:2NH3(g) N2(g)+3H2(g),
N2(g)+3H2(g),
反应时间(t)与容器内气体总压强(p)的数据见下表
时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
总压强p 100 kPa | 5 | 5.6 | 6.4 | 6.8 | 7 | 7 |
则平衡时氨气的转化率为___________。
(3)25℃,某二元弱酸H2A与NaOH溶液反应可生成NaHA、Na2A,溶液中含A各微粒的分布分数(平衡时某含A微粒的浓度占各含A微粒浓度之和的分数)随溶液变化的情况如下图所示:
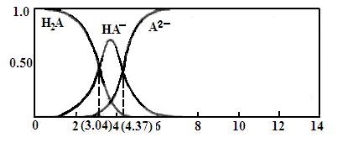
已知:103.04=1.1×103,104.37=2.3×104 25℃,Ka1(H2CO3)= 4.4×10-7 Ka2(H2CO3) = 4.7×10-11
①若向0.1NaHAmol·L-1溶液中加入少量NaOH溶液,c(A2-)/c(HA-)的值 (填“增大”、“减小”或“不变”,下同),c(H+)/c(OH-) 的值 。
②若向0.1NaHAmol·L-1溶液中加入氨水至溶液呈中性,则c(H2A)+c(NH4+) c(A2-) (填“大于”、“小于”或“等于”)。
③计算HA-二级电离平衡常数Ka2= 。
④将过量H2A加入Na2CO3溶液中反应的离子方程式为: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉市高三四月调考理综化学试卷(解析版) 题型:选择题
下列说法不正确的是:
A.通过煤的干馏可获得苯、甲苯等芳香烃
B.在海轮外壳装上锌块,可减缓船体的腐蚀速率
C.电渗析法、离子交换法中,只有后者可以应用于海水的淡化
D.我国城市推广使用清洁燃料是压缩天然气类和液化石油气类
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com