
|
在无色溶液中,下列离子能大量共存的是: | |
| [ ] | |
A. |
NH |
B. |
K+、SO |
C. |
K+、Fe3+、Cl-、NO |
D. |
Ba2+、Na+、OH-、CO |
科目:高中化学 来源: 题型:阅读理解
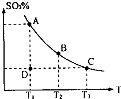 (1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
(1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:| Kw |
查看答案和解析>>
科目:高中化学 来源:非常讲解·教材全解全析 高中化学 必修1 (山东版) 山东版 题型:022
在下列物质的转化关系中,A是一种固体单质,E是一种白色沉淀,C是一种可溶于水的无色盐.

回答下列问题:
(1)物质的化学式:A________、B________、C________、D________、E________F________.
(2)A与X溶液反应的化学方程式:________,B与X溶液反应的离于方程式:________.
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省许昌市五校高一第四次联考化学试卷(带解析) 题型:填空题
A、B、C、D、E、F是原子序数依次增大的六种常见元素。E的单质在C2中燃烧
的产物可使品红溶液褪色。F和C元素形成的化合物F3C4具有磁性。A的单质在C2中燃烧
可生成AC和AC2两种气体。D的单质是一种金属,该金属在AC2中剧烈燃烧生成黑、白两
种固体。请回答下列问题:
⑴B的单质分子的电子式为 ;F3C4的化学式为 ;
F元素在周期表中的位置是_____________。
⑵写出D在AC2剧烈燃烧生成黑白两种固体的化学反应方程式
⑶A、B、C形成的10电子氢化物中,A、B的氢化物沸点较低的是(写化学式)____________;
B、C的氢化物分子结合H+能力较强的是(写化学式)______________,用一个离子
方程式加以证明____________________________。
⑷EC2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体BC,有关反应的离
子方程式为__________________________________________,由此可知BC2和EC2还
原性较强的是(写化学式)______________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年陕西省西安市高三第一次质检化学试卷(解析版) 题型:计算题
(1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为: ,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:

①反应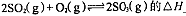 0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强 (填“增大”、“减小”或“不变”),平衡 移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量 __(填“增大”、“减小”或“不变”),O2的物质的量浓度
(填“增大”、“减小”或“不变”)。
0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强 (填“增大”、“减小”或“不变”),平衡 移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量 __(填“增大”、“减小”或“不变”),O2的物质的量浓度
(填“增大”、“减小”或“不变”)。
②若温度为T1、 T2,反应的平衡常数分别为K1、K2 则K1 K2(填“>”、“<”或“=”),反应进行到D点状态时,V正 V逆(填“>”、“<”或“=”)
③在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10 mol O2,在500℃开始反应,半分钟达到平衡,测得容器内含SO3 0.18 mol,则v(O2)= mol·L-1·min-1,若继续通入0.20 mol SO2和0.10 mol O2,平衡发生了移动,再次达到平衡后, mol<n(SO3)< mol.
(2)已知三种无色溶液:a.NaHCO3溶液,b.AlCl3溶液,c.NaAlO2溶液,它们两两反应均能生成Al(OH)3沉淀。请回答下列问题:
①两种溶液恰好完全反应,所得溶液中c(OH—)= 是水的离子积),则这两种溶液可为 (填字母)。
是水的离子积),则这两种溶液可为 (填字母)。
②能体现出NaHCO3在反应中,HCO—3的水解程度小于电离程度的离于方程式为 。
查看答案和解析>>
科目:高中化学 来源:2011届山西省太原市高三模拟(二)(理综)化学部分 题型:填空题
已知A~N分别代表一种物质,它们之间的转化关系如图所示(部分反应的反应条件和生成物已略去)。A、B、C分别是由短周期元素组成的单质,A是金属,D是无色液体。F是一种离子化含物,其阴阳离子的个数比为1:3,且能与水反应得到两种碱。反应①是实验室检验某离予的方法,反应②是工业、生产N的重要反应。请回答下列问题:
(1)B元素在元素周期表中的位置是 ,F的电子式是 。
(2)写出反应①的离子方程式:
(3)Cu与足量的N的浓溶液反应得到的产物主要是M不是L,其原因是
(请用上图所示关系中反应的化学方程式回答)。
(4)选择性催化还原(SCR)是在有催化剂的条件下将M转变为无毒的物质,这是目前国外进行尾气治理遍采用的一种方法。亚铬酸铜(Adkin偿化剂)是极好的M催化还原的催化剂,是铜和铬的复合氧化物,成分不固定,如:aCuO·bCr2O3等,统称为亚铬酸铜。
CuNH4(OH)CrO4在295℃分解生成复合的氧化物(催化剂)、氮气及水,写出该反应的
化学方程式: 。
(5)已知一定温度(>100℃)下,反应②的平衡常数为1。将0.8 mol K和1.1mol B放入容积为1L的封闭容器中,发生反应②,一段时间后L的浓度为0.4 mol/L,此时反应v正 v逆(填“>”、“<”或“=”)。 当反应到达平衡后,保持温度不变,再加入一定物质的量的B,重新达到平衡,则L的平衡浓度 (填“增大”、“不变”或“减小”),B的转化率
_。(填“升高”、“不变”或“降低”),L的体积分数 (填“增大”、“不变”、“减小”或“无法确定”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com