
| V |
| Vm |
| 1.344L |
| 22.4L/mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 如图为摇摆电池的工作原理图,在充放电过程中Li+在两极间“摇来摇去”,其总反应为:LiCoO2+6C
如图为摇摆电池的工作原理图,在充放电过程中Li+在两极间“摇来摇去”,其总反应为:LiCoO2+6C | 充电 |
| 放电 |
| A、放电时,负极反应为:LiCoO2-═Li(1-x)CoO2+xLi+ |
| B、充电时,B极发生还原反应 |
| C、充电时,Li+穿过隔离膜向B极移动 |
| D、当A极得到x mol电子,电池消耗6 mol C |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 液体试剂 | 固体药品 |
| 稀硫酸、稀盐酸、稀硝酸、NaOH溶液、浓氨水、5%H2O2溶液、浓盐酸、饱和食盐水 | CaCO3、CaO、MnO2、KMnO4、CaC2、 碱石灰、Cu、Zn、Na2S |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | A | B | C | D |
| 目的 | 压强对平衡的影响 | 温度对转化率的影响 | 增加O2浓度对速率的影响 | 浓度对平衡常数的影响 |
图示 |  | 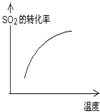 |  | 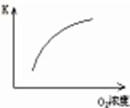 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 城市 | 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 甲 | 55 | SO2 | Ⅱ | 良 |
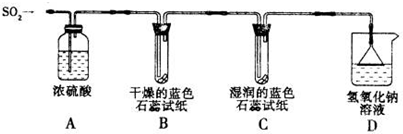
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,下列关于这种物质的说法中正确的是( )
,下列关于这种物质的说法中正确的是( )| A、分子式为C9H12 |
| B、易发生取代反应,难发生加成反应 |
| C、可使溴的四氯化碳溶液褪色 |
| D、该物质易溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com