
| A. | 在该反应中,硫元素被氧化 | |
| B. | 上述反应中,Y为氮气 | |
| C. | 红色固体是氧化亚铜 | |
| D. | 98g H2SO4参与反应,必转移0.5NA个电子(NA为阿伏伽德罗常数的值) |
分析 由信息可知,酸性条件下,有红色固体生成,则生成Cu,产生刺激性气味的气体,则生成SO2,溶液呈现蓝色,则生成Cu2+,即NH4CuSO3与足量的硫酸溶液混合微热生成硫酸铜、硫酸铵、二氧化硫、Cu,其反应为反应的方程式为2NH4CuSO3+4H+═Cu+Cu2++2SO2↑+2H2O+2NH4+,显然该反应中只有Cu元素的化合价升降,以此来解答.
解答 解:由信息可知,酸性条件下,有红色固体生成,则生成Cu,产生刺激性气味的气体,则生成SO2,溶液呈现蓝色,则生成Cu2+,即NH4CuSO3与足量的硫酸溶液混合微热生成硫酸铜、硫酸铵、二氧化硫、Cu,其反应为反应的方程式为2NH4CuSO3+4H+═Cu+Cu2++2SO2↑+2H2O+2NH4+,显然该反应中只有Cu元素的化合价升降,
A.NH4CuSO3中硫元素的化合价不变,故A错误;
B.酸性条件下,产生刺激性气味的气体,则生成SO2,即Y为SO2,故B错误;
C.由分析可知,红色固体为Cu,故C错误;
D.2NH4CuSO3+4H+═Cu+Cu2++2SO2↑+2H2O+2NH4+,由方程式可知,反应只有Cu元素的化合价发生变化,分别由+1→+2,+1→0,每2molH2SO4参加反应则转移1mol电子,则1molH2SO4完全反应转移0.5mol电子,故D正确;
故选D.
点评 本题考查氧化还原反应,明确现象与生成物的关系,并准确判断元素的化合价变化是解答本题的关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 向CuCl2溶液中加入铁粉 | |
| B. | 向FeO粉末中加入稀硫酸 | |
| C. | 单质Fe与过量稀盐酸反应后的溶液中再加入少量氯水 | |
| D. | Fe(OH)3与过量稀盐酸反应后的溶液中再加入过量铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液与过量氨水 Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| B. | 明矾净水原理:Al3++3H2O→Al(OH)3↓+3H+ | |
| C. | 将足量氯气通入溴化亚铁溶液:2Fe2++Cl2→2Fe3++2Cl- | |
| D. | 偏铝酸钠溶液与过量盐酸AlO2-+H++H2O→Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
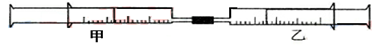
| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
| 1 | 10mL FeSO4溶液 | 10mLNH3 | 生成白色沉淀,后变色 |
| 2 | 5mL1mol/L FeCl3溶液 | 1mL1mol/L KSCN溶液 | |
| 3 | 10mL1mol/LAlCl3溶液 | 1mol/L NaOH | |
| 4 | 10mL2mol/LKAl(SO4)2溶液 | 1mol/LBa(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:1 | B. | 4:1 | C. | 3:2 | D. | 1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 此氨水的pH为11.48 | |
| B. | Q溶液中:c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+) | |
| C. | Q溶液中:2c(Cl-)=c(NH3•H2O)+c(NH4+) | |
| D. | 滴加过程中,溶液中可能会存在:c(NH4+)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当1 mol白磷完全转变成红磷时放出17kJ热量 | |
| B. | 正反应是一个放热反应 | |
| C. | 当4g红磷转变成白磷时吸收I7k J热量 | |
| D. | 白磷比红磷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
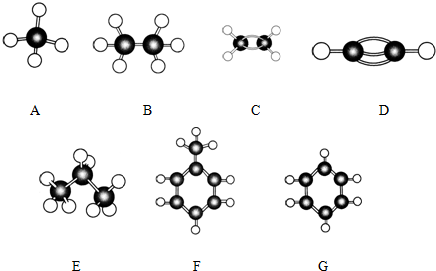
 +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$ +H2O;
+H2O;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com