
【题目】2014年,全国很多地区都曾出现严重的雾霾天气,汽车尾气、冬季取暖排放的CO2等都是形成雾霾的因素。请回答下列问题:
将不同物质的量的H2O(g)和CO分别通入容积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g)![]() CO2(g)+H2(g),得到3组数据如表所示:
CO2(g)+H2(g),得到3组数据如表所示:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡状态所需时间/min | ||
H2O | CO | CO | H2 | |||
1 | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
2 | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
3 | 900 | a | b | c | d | t |
(1)实验1中0~5min内,以v(CO2)表示的化学反应速率为______,此温度下的化学平衡常数为______,温度升高时化学平衡常数会_______(填“增大”“减小”或“不变”)。
(2)若a=2,b=1,则达到平衡状态时实验2中H
【答案】0.16mol·L-1·min-1 ![]() 减小 =
减小 =
【解析】
(1)在反应开始时,c(H2O)=1mol/L,c(CO)=2mol/L,c(CO2)=c(H2)=0,反应达到平衡时,c(CO)=1.2mol/L,反应消耗了0.8mol/L,则根据物质反应关系可知此时c(H2O)=(1-0.8)mol/L=0.2mol/L,c(CO2)=c(H2)=0.8mol/L,实验1中0~5min内,以v(CO2)表示的化学反应速率v(CO2)=![]() =0.16 mol·L-1·min-1;此温度下该反应的化学平衡常数K=
=0.16 mol·L-1·min-1;此温度下该反应的化学平衡常数K=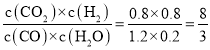 ;第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时H2的物质的量比第一组的一半少,说明升高温度平衡逆向移动,逆反应是吸热反应,则该反应正向是放热反应;温度升高时,平衡逆向移动,化学平衡常数会减小;
;第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时H2的物质的量比第一组的一半少,说明升高温度平衡逆向移动,逆反应是吸热反应,则该反应正向是放热反应;温度升高时,平衡逆向移动,化学平衡常数会减小;
(2)反应H2O+CO![]() CO2+H2中,H2O和CO系数相等,根据转化率=
CO2+H2中,H2O和CO系数相等,根据转化率=![]() ,两种情况下,实验组2中H2O(g)转化量与起始量之比一定等于实验组3中CO的转化量与起始量,所以α2(H2O)=α3(CO)。
,两种情况下,实验组2中H2O(g)转化量与起始量之比一定等于实验组3中CO的转化量与起始量,所以α2(H2O)=α3(CO)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.向NaAlO2溶液中通入过量CO2:![]()
B.铝与氯化铜溶液反应:![]()
C.次氯酸钙溶液中通入SO2气体:![]()
D.在溶液中NH4HCO3与NaOH以等物质的量混合:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,1mol甲基(-14CD3)所含的中子数和电子数分别为11NA、9NA
B.CH4和P4都是正四面体结构,物质的量相同的CH4和P4的共价键数之比为![]()
C.标准状态下,1molH2和1molF2混合后,所含气体的体积为44.8L
D.常温常压下,0.5molFe和足量浓硝酸混合,转移电子数为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I是制备预防髋或膝关节置换术后静脉血栓栓塞药物的医药中间体。其一种合成路线如图:
请回答下列问题:
(1)G中官能团的名称为__;C的化学名称为__。
(2)C→D的反应类型为__。
(3)F→G所需的试剂![]() 为__。
为__。
(4)G→H的化学方程式为__。
(5)M为H的同分异构体,同时满足下列条件的M有__种(不考虑立体构);其中核磁共振氢谱显示6种不同环境的氢,且峰面积之比为1:1:1:1:2:4的结构简式为__(写出任意一种)。
①苯环上有三个取代基且其中两个为氨基
②1molM分别与足量Na或NaHCO3溶液反应,均能产生气体且生成气体的物质的量相同。
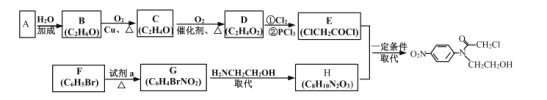
(6)参照上述流程和信息,设计以甲苯和H2NCH2CH2OCH2COCl为原料(无机试剂任选)制备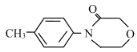 的合成路线:__。
的合成路线:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数的值,下列叙述正确的是( )
表示阿伏加德罗常数的值,下列叙述正确的是( )
A.100g 98%![]() 溶液中含氧原子数为
溶液中含氧原子数为![]()
B.28g![]() 与
与![]() 混合气体中含有原子的数目为
混合气体中含有原子的数目为![]()
C.标准状况下,11.2L![]() 含有的分子数为
含有的分子数为![]()
D.含有![]() 个氧原子的氧气在标准状况下的体积为22.4L
个氧原子的氧气在标准状况下的体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通过反应:Al2O3+3C+3Cl2 ![]() 2AlCl3+3CO 制取无水氯化铝,下列关于该反应的说法正确的是
2AlCl3+3CO 制取无水氯化铝,下列关于该反应的说法正确的是
A.Al2O3是氧化剂B.CO是氧化产物
C.每生成1 mol AlCl3,转移3个电子D.C发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成单质和化合物最多的元素,其单质及化合物有独特的性质和用途。请回答下列问题。
(1)C原子的价电子轨道表达式为__。
(2)碳可以形成多种有机化合物,如图所示是一种嘌呤和一种吡啶的结构,两种分子中所有原子都在一个平面上。
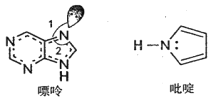
①嘌呤中所有元素的电负性由大到小的顺序__。
②吡啶结构中N原子的杂化方式是___。
③NH3的键角__PH3的键角,理由是__。
④分子中的大π键可以用符号π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为__。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为__。
(3)石墨烯中部分碳原子被氧化后,转化为氧化石墨烯。
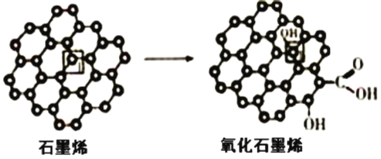
石墨烯转化为氧化石墨烯时,1号C与相邻C原子间键能的变化是__(填“变大”、“变小”“不变”)。
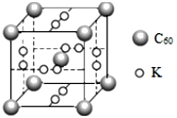
(4)石墨烯可转化为富勒烯(C60),C60和K能形成新型化合物,其晶胞如图所示,晶胞参数为anm该化合物中K原子和C60分子的个数比为___,该晶体的密度ρ=___g/cm3(阿伏加德罗常数为6.02×1023)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种钾离子电池的工作原理如图所示,下列说法正确的是

A.放电时,负极的电极反应式 :KC6 –e- =K ++6C
B.充电时,阳极的电极反应式 :K0.5-xMnO2+xK++ xe-=K0.5MnO2
C.放电时,K+ 通过阳离子交换膜向石墨电极移动
D.若仅把钾离子换成锂离子,当负极减少的质量相同时,钾离子电池转移的电子数比锂离子电池的多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验。
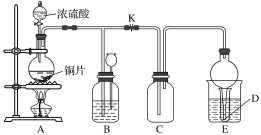
实验中某同学将a g铜片和12 mL 18 mol·L-1的浓硫酸放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的H2SO4和Cu剩余。
请回答:
(1)请写出Cu与浓硫酸反应的化学方程式:_____________________________。
(2)装置E中试管D内盛品红溶液,当C中气体收集满后,D中有可能观察到的现象是______________________。
实验装置E中D有可能造成环境污染,试用最简单方法加以解决(实验用品自选)______________。
装置B的作用是储存多余的气体。当D处有明显现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是____________________。B中应放置的液体是________(填字母)。
A 饱和Na2SO3溶液 B 酸性KMnO4溶液 C 浓溴水 D 饱和NaHSO3溶液
(3)问题讨论:为什么有一定量的余酸还未能使Cu完全溶解。你认为原因是______________________。
足量下列药品能够用来证明反应结束后的烧瓶中的确有余酸的是________(填字母)。
A Fe B BaCl2溶液 C Ag D Na2CO3溶液
(4)实验中该同学向A中反应后溶液中通入一种气体单质,使铜片全部溶解且仅生成硫酸铜溶液,请问该气体单质是__________(填名称),反应的化学方程式是__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com