
“酒是陈的香”,就是因为酒在储存过程中生成了有香味乙酸乙酯,在实验室我们也可以用下图所示的装置制取乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式 。
(2)饱和碳酸钠溶液的主要作用是中① ② ;③
(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液,
目的是防止 。
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(5)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应未达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
(1)
(2) ① 减少乙酸乙酯的溶解度 ② 除去乙酸 ;③ 除去乙醇
(3) 倒吸
(4)分液
(5) ①③
解析试题分析:(1)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,其反应方程式为 ;(2)饱和碳酸钠溶液的主要作用是减少乙酸乙酯的溶解度 、除去乙酸 、 除去乙醇;(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,因为蒸汽含有乙醇乙酸,所以不能插入溶液,目的是防止倒吸;(4)乙酸乙酯不溶于饱和碳酸钠溶液,所以可以用分液的方法将其分离;(5)根据
;(2)饱和碳酸钠溶液的主要作用是减少乙酸乙酯的溶解度 、除去乙酸 、 除去乙醇;(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,因为蒸汽含有乙醇乙酸,所以不能插入溶液,目的是防止倒吸;(4)乙酸乙酯不溶于饱和碳酸钠溶液,所以可以用分液的方法将其分离;(5)根据 可以知道,单位时间里,生成1mol乙酸乙酯,同时生成1mol水或者是单位时间里消耗1mol乙醇,同时消耗1mol乙酸,不能说明反应已经达到平衡,其他都可以说明反应达到平衡,故本题的答案选择①③。
可以知道,单位时间里,生成1mol乙酸乙酯,同时生成1mol水或者是单位时间里消耗1mol乙醇,同时消耗1mol乙酸,不能说明反应已经达到平衡,其他都可以说明反应达到平衡,故本题的答案选择①③。
考点:酯化反应
点评:该题考查了酯化反应,乙酸乙醇的酯化反应是中心的经典反应,是高考考查的重点,本题属于对基础知识的考查,难度不大。


科目:高中化学 来源: 题型:
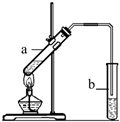 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题: CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
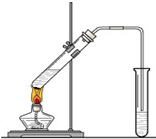 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
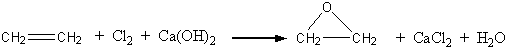
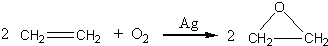
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用右图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用右图所示的装置制取乙酸乙酯.回答下列问题: CH3CO18OCH2CH3+H2O
CH3CO18OCH2CH3+H2O CH3CO18OCH2CH3+H2O
CH3CO18OCH2CH3+H2O查看答案和解析>>
科目:高中化学 来源: 题型:
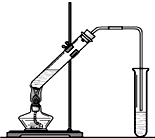 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
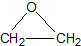
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: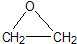 +CaCl2+H2O
+CaCl2+H2O| Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com