
【题目】某溶液中可能含有OH-、AlO2-、SiO32-、CO32-、SO42-、K+、Na+、Fe3+、Mg2+、Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )
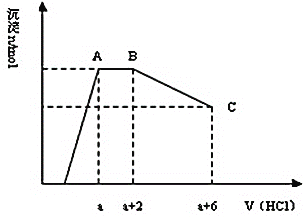
A.原溶液中一定含有Na2SO4
B.反应后形成的溶液溶质为NaCl
C.原溶液中含有CO32-与AlO2-的物质的量比为3:4
D.原溶液中一定含有的离子是OH-、AlO2-、SiO32-、CO32-、K+
【答案】C
【解析】
根据图像分析得出开始阶段是H+和OH-的反应,说明溶液中有OH-,则说明原溶液中没有Fe3+、Mg2+、Al3+,一定含有K+和Na+其中一种或者两种;随后是生成沉淀的阶段,能够与H+反应生成沉淀的,有SiO32-和AlO2-;AB为水平线,沉淀质量不变,说明有气体生成,说明含有CO32-,BC是沉淀减少的阶段,说明有以沉淀能够溶于盐酸,则沉淀中含有Al(OH)3,但是沉淀没有完全消失,最后沉淀为硅酸。
A、根据以上分析原溶液中不一定含有Na2SO4,故A错误;
B、反应后形成的溶液溶质可能为NaCl或KCl,故B错误;
C、根据图像CO32-消耗2体积盐酸,沉淀Al(OH)3消耗4体积盐酸,CO32- + 2 H+ = CO2↑+ H2O,Al(OH)3 + 3 H+ = Al3+ + 3H2O,原溶液中含有CO32-与AlO2-的物质的量比为1: ![]() =3:4,故C正确;
=3:4,故C正确;
D、原溶液中一定含有的离子是OH-、AlO2-、SiO32-、CO32-,而可能含有K+,故D错误;
答案为C。


科目:高中化学 来源: 题型:
【题目】下列四种溶液中,室温下由水电离生成的H+浓度之比(①∶②∶③∶④)是
① 1 mol·L-1的盐酸 ② 0.1 mol·L-1的盐酸
③ 0.01 mol·L-1的NaOH溶液 ④ 0.001 mol·L-1的NaOH溶液
A. 1∶10∶100∶1 000B. 0∶1∶12∶11C. 14∶13∶12∶11D. 14∶13∶2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是常见的二次电池,电池总反应为:Pb+PbO2+2H2S4![]() 2PbSO4+2H2O,下列说法正确的是
2PbSO4+2H2O,下列说法正确的是
A. 放电时的负极反应式为Pb+SO42- -2e-=PbSO4
B. 充电时铅蓄电池的正极与外接电源的负极相连
C. 放电时PbO2发生氧化反应
D. 充电时的阴极反应式为PbSO4+2H2O-2e-=PbO2+SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表示下列变化的化学用语正确的是
A. 氨水显碱性:NH3·H2O![]() NH4++OH-
NH4++OH-
B. 醋酸溶液显酸性:CH3COOH=CH3COO-+H+
C. NaHCO3溶液显碱性:HCO3-+H2O![]() CO32-+OH-
CO32-+OH-
D. 铁在潮湿空气中被腐蚀的负极反应:Fe-3e-=Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家一直致力于“人工固氮”的研究,现已有多种方法。
(方法一)
1918年,德国化学家哈伯因发明工业合成氨的方法而荣获诺贝尔化学奖。
(1)若将1 mol N2和3 mol H2放入1L的密闭容器中,5min后N2的浓度为0.8mol/L,这段时间内用N2的浓度变化表示的反应速率为________mol/(L·min)。
(2)在一定温度下的定容密闭容器中发生上述反应,下列叙述能说明反应已经达到平衡状态的是________________。
a. υ(N2)正=3υ(H2)逆
b. 容器中气体的密度不随时间而变化
c. 容器中气体的分子总数不随时间而变化
d. 容器中气体的平均相对分子质量不随时间而变化
(3)若1 mol N2完全转化为NH3的反应热为![]() H=-92 kJ/mol,拆开1 mol H—H键和1 mol N
H=-92 kJ/mol,拆开1 mol H—H键和1 mol N![]() N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是__________kJ。
N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是__________kJ。
(4)合成氨反应的生产条件选择中,能用勒夏特列原理解释的是________________。
①使用催化剂 ②高温 ③高压 ④及时将氨气液化从体系中分离出来
A. ①③ B. ②③ C. ③④ D. ②④
(方法二)
1998年,两位希腊化学家提出了电解合成氨的新思路:
采用高质子导电性的SCY陶瓷(能传递H+)为介质,实现了高温(570℃)常压下高转化率的电解法合成氨,转化率可达到78%,装置如下图:
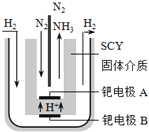
钯电极A是电解池的________极(填“阳”或“阴”),阳极反应式为__________________。
(方法三)
最新的“人工固氮”研究报道:在常温、常压、光照条件下,N2在催化剂表面与水发生反应,直接生成氨气和氧气:
已知:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g) ![]() H=-92 kJ/mol
H=-92 kJ/mol
2H2(g)+O2(g)=2H2O(1) ![]() H=-571.6 kJ/mol
H=-571.6 kJ/mol
写出上述固氮反应的热化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究FeCl3溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
(1)配制50 mL 1.0 mol·L1的FeCl3溶液,测其pH约为0.7,即c(H+) = 0.2 mol·L1。
① 用化学用语解释FeCl3溶液呈酸性的原因: 。
② 下列实验方案中,能使FeCl3溶液pH升高的是 (填字母序号)。
a. 加水稀释 b. 加入FeCl3固体
c. 滴加浓KSCN溶液 d. 加入NaHCO3固体
(2)小组同学利用上述FeCl3溶液探究其与足量锌粉的反应。实验操作及现象如下:
操作 | 现象 |
向反应瓶中加入6.5 g锌粉,然后加入50 mL 1.0 mol·L1的FeCl3溶液,搅拌 | 溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色,反应瓶底部有黑色固体 |
收集检验反应过程中产生的气体 | 集气管口靠近火焰,有爆鸣声 |
已知:Zn的性质与Al相似,能发生反应:Zn + 2NaOH = Na2ZnO2 + H2 ↑
① 结合实验现象和平衡移动原理解释出现红褐色沉淀的原因: 。
② 用离子方程式解释反应后溶液为浅绿色的原因: 。
③ 分离出黑色固体,经下列实验证实了其中含有的主要物质。
i. 黑色固体可以被磁铁吸引;
ii. 向黑色固体中加入足量的NaOH溶液,产生气泡;
iii. 将ii中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
iv. 向iii反应后的溶液中滴加KSCN溶液,无变化。
a. 黑色固体中一定含有的物质是 。
b. 小组同学认为上述实验无法确定黑色固体中是否含有Fe3O4,理由是 。
(3)为进一步探究上述1.0 mol·L1 FeCl3溶液中Fe3+和H+氧化性的相对强弱,继续实验并观察到反应开始时现象如下:
操作 | 现象 |
将5 mL 1.0 mol·L1的FeCl3溶液与0.65 g锌粉混合 | 溶液温度迅速上升,开始时几乎没有气泡 |
将 与0.65 g锌粉混合 | 溶液中立即产生大量气泡 |
小组同学得出结论:在1.0 mol·L1 FeCl3溶液中,Fe3+的氧化性比H+更强。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述正确的是( )
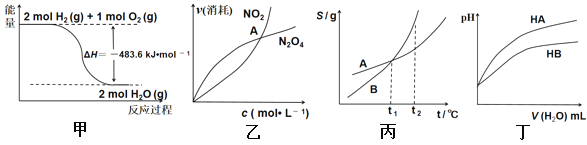
A. 甲表示H2与O2发生反应过程中的能量变化,则H2的标准燃烧热为△H=-483.6kJ·mol-1
B. 乙表示恒温恒容条件下发生的可逆反应2NO2 (g)![]() N2O4 (g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4 (g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C. 丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D. 丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙以及物质C、D、E、F,它们之间能发生如图反应。(图中有些反应的产物和反应条件没有标出)
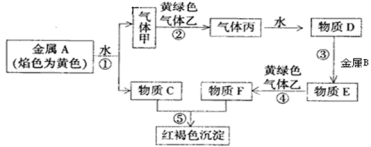
请回答下列问题:
(1)丙的化学式为____。
(2)A的一种氧化物为淡黄色固体,该物质的电子式为___。
(3)写出气体乙与C溶液反应的离子方程式:____。
(4)若将C溶液与E溶液混合,则可以观察到的现象是:____。
(5)配制F溶液时,要将F固体先溶于较浓的盐酸中,再加水稀释,其目的是___(用简单文字和离子方程式说明)。
(6)设计一种检验物质E溶液中金属阳离子实验方案:____(写出实验步骤,现象和结论)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸H2C2O4(一种二元弱酸)能使酸性高锰酸钾溶液褪色,其反应可以表示如下:2KMnO4+3H2SO4+5H2C2O4=K2SO4+2MnSO4+10X↑+8H2O
(1)已知相同条件下X气体对H2的相对密度为22,则X的化学式为__;
(2)该反应中的氧化剂是__,还原剂是__(填化学式)。
(3)若该反应中生成的还原产物的物质的量为0.2mol,则生成的X气体在标况下的体积为__。
(4)写出该反应的离子方程式:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com