
| A. | K+、Fe3+、Cl-、SCN- | B. | NH4+、H+、NO3-、SO42- | ||
| C. | Ba2+、Na+、HCO3-、SO42- | D. | Fe2+、K+、MnO4-、OH- |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
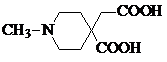 .
.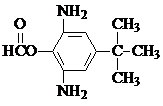 或
或 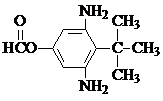 .
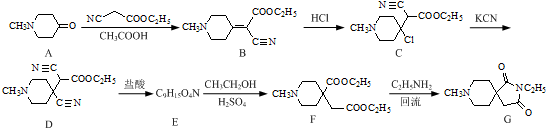
.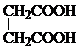 和CH3CH2Cl为原料制备
和CH3CH2Cl为原料制备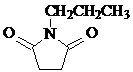 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的NaOH溶液中:K+、Na+、SO42-、CO32- | |
| B. | 0.1 mol•L-1的Na2CO3溶液中:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1 mol•L-1的FeCl3溶液中:K+NH4+、I-、SCN- | |
| D. | 0.1 mol•L-1的盐酸中:Fe2+、Na+、Br-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨、液氯、干冰、碘化银均为化合物 | |
| B. | 明矾、小苏打、醋酸、次氯酸均为电解质 | |
| C. | 碘酒、牛奶、豆浆、漂白粉均为胶体 | |
| D. | Na2O2、Na2CO3、Na2SiO3、KNO3均为盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2CO3比NaHCO3易溶于水 | |
| B. | NaHCO3比Na2CO3稳定 | |
| C. | 澄清的石灰水能与Na2CO3反应,不与NaHCO3反应 | |
| D. | 等物质的量的Na2CO3和NaHCO3与等浓度足量的盐酸反应,消耗盐酸体积之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1 的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1 的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )| A. | 曲线①代表滴定HCl溶液的曲线 | |
| B. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1mol•L-1 | |
| C. | 在相同温度下,A、B、C三点溶液中水的电离程度:C<B<A | |
| D. | D点溶液中:c(Cl-)=2c(OH-)-2c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
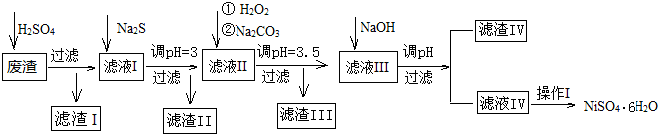
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | CuS | ZnS | FeS | NiS | Al(OH)3 | Mg(OH)2 | Ni(OH)2 |
| pH | 3.2 | 9.7 | ≥-0.42 | ≥2.5 | ≥7 | ≥7.5 | ≥5 | ≥8 | ≥8.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO3溶液 | B. | NH4HCO3溶液 | C. | NaHCO3溶液 | D. | NaHSO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com