
【题目】在恒温恒容条件下,可逆反应:![]() ,在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是( )(Qc表示浓度熵)
,在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是( )(Qc表示浓度熵)
容器 | 体积 | 起始物质 | 平衡时C的物质的量 | 平衡时B的体积分数 | 平衡常数 |
甲 | 1L |
| 1mol |
|
|
乙 | 1L |
|
|
|
|
丙 | 2L |
|
|
|
|
A.在建立平衡的过程中,甲的Qc逐渐减小,乙和丙的Qc逐渐增大
B.![]()
C.升高甲的温度,可使![]()
D.![]() ,
,![]()
【答案】C
【解析】
A.K=![]() ,在反应起始时,Qc(甲)=0,Qc(乙)、Qc(丙)则可认为是无穷大,故在平衡的建立过程中,甲的Qc逐渐增大,乙、丙的Qc逐渐减小,选项A错误;
,在反应起始时,Qc(甲)=0,Qc(乙)、Qc(丙)则可认为是无穷大,故在平衡的建立过程中,甲的Qc逐渐增大,乙、丙的Qc逐渐减小,选项A错误;
B.化学平衡常数只与温度有关,温度相同,其化学平衡常数相同,所以![]() ,选项B错误;
,选项B错误;
C. 若条件是恒压,甲、乙平衡时,B的体积分数相同,但题中的条件是恒容,故乙中压强大于甲,增大压强,平衡向逆反应方向移动,即乙中B的体积分数要大于甲;该反应的正反应是放热反应,升高甲的温度,平衡向逆反应方向移动,导致甲B的体积分数增大,所以存在![]() ,选项C正确;
,选项C正确;
D.由于温度恒定,故K![]() ;
;
对应甲:
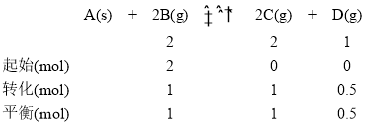
由于体积为1L,则利用物质的量代替浓度计算平衡常数,则平衡常数![]() ,温度相同,化学平衡常数相同即
,温度相同,化学平衡常数相同即![]() ,乙中
,乙中![]() 、
、![]() 、
、![]() ,
,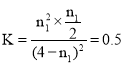 ,
,![]() ;
;
丙中![]() 、
、![]() 、
、![]() ,
,
 ,选项D错误;
,选项D错误;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】T ℃时,在体积恒定的真空密闭容器中发生反应:![]() 。反应过程中X、Y、Z的物质的量随时间变化的曲线如图所示。下列说法不正确的是( )
。反应过程中X、Y、Z的物质的量随时间变化的曲线如图所示。下列说法不正确的是( )
A.Y的体积分数不再发生变化,可判断反应达到平衡状态
B.![]()
C.![]() 时,X有
时,X有![]() mol参加反应
mol参加反应
D.![]() 时,Y的正反应速率等于Z的逆反应速率
时,Y的正反应速率等于Z的逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
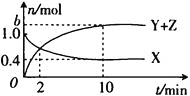
【题目】在一定条件下,碘单质可与环戊烯![]() 反应生成环戊二烯
反应生成环戊二烯![]() :
:![]() 。现向1L密闭容器中加入
。现向1L密闭容器中加入![]() 和环戊烯
和环戊烯![]() 各
各![]() 使其发生上述反应,实验测得反应体系中
使其发生上述反应,实验测得反应体系中![]() 的物质的量
的物质的量![]() 随时间
随时间![]() 的变化如图所示,下列说法错误的是
的变化如图所示,下列说法错误的是

A.当环戊烯![]() 和环戊二烯
和环戊二烯![]() 的生成速率相等时,反应达到平衡
的生成速率相等时,反应达到平衡
B.![]() min内生成HI的反应速率
min内生成HI的反应速率![]()
![]()
C.10min时,环戊烯![]() 的转化率为
的转化率为![]()
D.![]() 后图线变化可能是反应体系温度升高所致
后图线变化可能是反应体系温度升高所致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)俗称吊白块,不稳定,120℃时会分解。在印染、医药以及原子能工业中有广泛应用。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:

步骤1:在三颈烧瓶中加入一定量Na2S03和水,搅拌溶解,缓慢通入SO2,至溶液pH约为4,制得NaHS03溶液。
步骤2:将装置A中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤;
步骤3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置B的烧杯中应加入的溶液是____:冷凝管中冷却水从____(填“a”,或“b”)口进水。
(2)A中多孔球泡的作用是________。
(3)冷凝管中回流的主要物质除H20外还有____(填化学式)。
(4)步骤3中在真空容器中蒸发浓缩的原因是____。
(5)为测定产品的纯度,准确称取2.Og样品,完全溶于水配成l00mL溶液,取20.00mL所配溶液,加过量碘完全反应后(己知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g,产品的纯度为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知t℃时,某些物质的平衡常数K的值如表所示,下列说法错误的是( )
物质 | HCIO | H2CO3 | AgCl | AgI |
平衡常数 | Ka≈10﹣9 | K≈10﹣7 K≈10﹣11 | Ksp≈1.8×10﹣10 | Ksp≈8.51×10﹣17 |
A.向新制氯水中加入少量NaHCO3增强氯水漂白性
B.相同温度和浓度下,NaClO溶液的pH比Na2CO3溶液的pH小
C.t℃时,AgCl(s)+I﹣(aq)![]() AgI(s)+Cl﹣(aq)的平衡常数K=2.1×106
AgI(s)+Cl﹣(aq)的平衡常数K=2.1×106
D.将AgCl和AgI的饱和溶液等体积混合,再加入足量AgNO3溶液,会生成等量的AgCl和AgI沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体化合物CaFe(CO3)2在空气中加热反应生成CO2、Fe2O3和CaO.回答下列问题:
(1)CO2的电子式为_____。
(2)上述反应产物中的CaO加入燃煤中,其作用是_____。
A.降低温室效应B.减少SO2的排放C.避免光化学烟雾D.保护臭氧层
(3)设计实验证明上述固体产物中含有三价铁:取少量固体于试管中,_____。
(4)CaFe(CO3)2在空气中加热反应的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
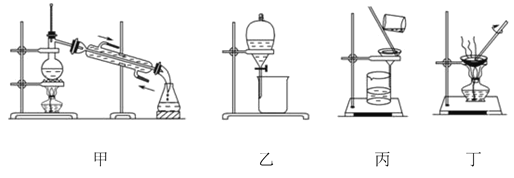
(1)为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
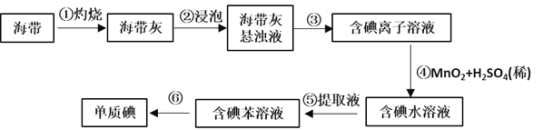
a.灼烧海带时,除需要三脚架、泥三角外,还需要用到实验仪器是_____(填字母)。
A.烧杯 B.坩埚 C.表面皿 D.酒精灯 E. 干燥器
b.步骤③的实验选择上述图_____(填“甲”“乙”或“丙”)装置。步骤⑤的实验操作名称是_____。步骤⑥的目的是从含碘苯溶液中分离出单质碘,同时回收苯,该步骤的实验操作名称是_____,选择上述图_____(填“甲”“乙”或“丙”)装置。
(2)某盐的混合溶液中含有Na+、Mg2+、Cl-、SO42-离子,测得Na+、Mg2+ 和Cl-的物质的量浓度依次为0.2molL-1、0.25molL-1、0.4molL-1,则c(SO42-)=_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是
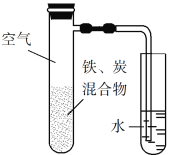
A. 铁被氧化的电极反应式为Fe3e![]() Fe3+
Fe3+
B. 铁腐蚀过程中化学能全部转化为电能
C. 活性炭的存在会加速铁的腐蚀
D. 以水代替NaCl溶液,铁不能发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铵[(NH4)2SO4]一种优良的氮肥(俗称肥田粉),适用于一般土壤和作物,能使枝叶生长旺盛,提高果实品质和产量,增强作物对灾害的抵抗能力,可作基肥、追肥和种肥,与氢氧化钙在加热的条件下可以生成氨气。根据所学知识回答下列问题:
(1)基态S原子的价电子排布式为____________,能量最高的电子所处的能层的符号为_________。
(2)SO42-空间构型为__________,中心原子的轨道杂化方式是________,写出一个与SO42-互为等电子体的分子的化学式__________。
(3)氨气的沸点(-33.5℃)高于硫化氢的沸点(-60.4℃)的主要原因是:_____________________________。
(4)O、N、S的第一电离能从大到小的顺序是___________________。
(5)硫酸铜溶液中通入过量的氨气会生成[Cu(NH3)4]SO4,1mol的[Cu(NH3)4]2+中σ键的个数为________。
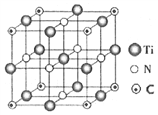
(6)以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构如下图所示,这种碳氮化钛化合物的化学式为________。若将该晶体的晶胞重新切割,使碳原子位于新晶胞的上下面心,则氮原子在新晶胞中的位置是__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com