
| A | B | C | D |
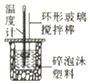 |  |  |  |
| 测中和热 | 向沸水中滴加FeCl3饱和溶液,在加热到出现红褐色沉淀,即制得Fe(OH)3胶体 | 实验室原油蒸馏 | 吸收CO2中的HCl杂质 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.根据温度计位置、保温措施等方面分析;
B.加热到出现红褐色沉淀,得到的是Fe(OH)3沉淀,不是胶体;
C.温度计水银球的位置错误,不能插入溶液中;
D.导管中通入气体方向错误,无法达到洗气的目的.
解答 解:A.温度计测量反应液温度,应插入溶液中,需要用环形玻璃棒搅拌,图示装置合理,能够达到实验目的,故A正确;
B.向沸水中滴入几滴FeCl3饱和溶液,继续煮沸至溶液变成红褐色,即可制得Fe(OH)3胶体,不能加热到出现红褐色沉淀,故B错误;
C.实验室原油蒸馏时,温度计的水银球应该放在蒸馏烧瓶的支管口处,不能伸入溶液,故C错误;
D.吸收CO2中的HCl杂质.导管应该采用长进短出的方式,图示通气方向合理,无法达到实验目的,故D错误;
故选A.
点评 本题考查化学实验方案的评价,题目难度不大,涉及蒸馏、中和热测定、物质分离与提纯等知识,明确常见化学实验基本操作方法为解答关键,试题培养了学生的分析能力及化学实验能力.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | 化合物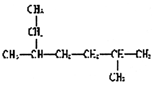 的名称为2-甲基-5-乙基己烷 的名称为2-甲基-5-乙基己烷 | |
| C. | 纤维素和油脂都是能发生水解反应的高分子化合物 | |
| D. | 甲烷、苯、乙醇、乙酸和酯类都可以发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 提出问题 | 收集资料 | 提出假设 | 验证假设 | 得出结论 |
| 氯水中何种物质能使湿润的红色布条褪色? | ①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 | ①氯气使布条褪色 ②盐酸使布条褪色 ③次氯酸使布条褪色 ④H2O使布条褪色 | 实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色; 实验②:把红色布条伸入稀盐酸中,红色布条不褪色 实验③:把红色布条伸入氯水中,红色布条褪色 实验④:把红色布条放在水里,布条不褪色. | 结论: 次氯酸使布条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| B. | 乳酸[CH3CH(OH)COOH]属于手性分子,因分子中存在手性碳原子 | |
| C. | 配合物中一定含有过渡金属原子或离子,因为过渡金属原子或离子存在空轨道 | |
| D. | 酸性H3PO4>HClO,是因为H3PO4分子非羟基氧原子数目比HClO多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
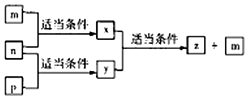 原子序数依次增大的短周期元素A、B、C、D分别位于不同的主族,m、p、n分别是元素A、B、C的单质,D的单质可与热水发生置换反应;x、y、z是由A、B、C组成的二元化合物,其中y、z是气体,且z可用于配制碳酸饮料.它们之间有如图转化关系,下列说法正确的是( )
原子序数依次增大的短周期元素A、B、C、D分别位于不同的主族,m、p、n分别是元素A、B、C的单质,D的单质可与热水发生置换反应;x、y、z是由A、B、C组成的二元化合物,其中y、z是气体,且z可用于配制碳酸饮料.它们之间有如图转化关系,下列说法正确的是( )| A. | D的单质起火燃烧时可用z作灭火剂 | B. | 元素的非金属性:C>A>B | ||
| C. | B、C与A形成化合物的沸点:C>B | D. | 原子半径:D>B>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡含有添加剂的食物对人体健康均有害,不宜食用 | |
| B. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| C. | 人体缺乏铁元素,可以补充硫酸亚铁,且多多益善 | |
| D. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com