

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |

分析 酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等,加入过氧化氢氧化亚铁离子为铁离子,加入碳酸钠溶液调节溶液的pH,使铝离子、铁离子全部沉淀,过滤后的滤液中再加入碳酸钠沉淀镍离子得NiCO3,滤液A中含有NaCl等物质,将NiCO3再溶于盐酸,得氯化镍溶液,向其中加入次氯酸钠和氢氧化钠溶液可得Ni2O3.
(1)升高温度、增大酸的浓度、充分搅拌、增大接触面积等可以提高浸出的速率;
(2)沉镍前要将铝离子和铁离子沉淀完全,而镍离子不能产生沉淀;
(3)滤液A中主要含有氯化钠,可回收利用;
(4)Cl元素由+1价降低到-1价,即反应生成NaCl,而Ni由+2价升高到+3价,根据原子守恒与电子转移守恒配平;
(5)①选择镍的成粉率最高的浓度;
②当NH4Cl浓度大于15g•L-1时,阴极有氢气生成,导致阴极电流效率降低.
解答 解:酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等,加入过氧化氢氧化亚铁离子为铁离子,加入碳酸钠溶液调节溶液的pH,使铝离子、铁离子全部沉淀,过滤后的滤液中再加入碳酸钠沉淀镍离子得NiCO3,滤液A中含有NaCl等物质,将NiCO3再溶于盐酸,得氯化镍溶液,向其中加入次氯酸钠和氢氧化钠溶液可得Ni2O3.
(1)为了提高金属镍废料浸出的速率,还可以增大盐酸的浓度(或将镍废料研成粉末等)等,
故答案为:增大盐酸的浓度(或将镍废料研成粉末等);
(2)沉镍前要将铝离子和铁离子沉淀完全,而镍离子不能产生沉淀,所以溶液的PH值控制在4.7~7.1,
故答案为:4.7~7.1;
(3)滤液A中主要含有氯化钠,可回收利用,
故答案为:NaCl;
(4)Cl元素由+1价降低到-1价,即反应生成NaCl,而Ni由+2价升高到+3价,生成Ni2O3,反应离子方程式为:2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O,
故答案为:2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O;
(5)①根据图2可知,NH4Cl的浓度为10g•L-1时,镍的成粉率最高,所以NH4Cl的浓度最好控制为10 g•L-1,
故答案为:10 g•L-1;
②当NH4Cl浓度大于15g•L-1时,阴极有氢气生成,导致阴极电流效率降低,电极反应式为2H++2e-=H2↑(或2NH4++2H2O+2e-=H2↑+2NH3•H2O),
故答案为:2H++2e-=H2↑(或2NH4++2H2O+2e-=H2↑+2NH3•H2O).
点评 本题考查物质制备工艺流程,涉及反应速率影响因素、条件控制、陌生方程式书写、电解原理、信息获取能力等,是高考常考题型,是对学生综合能力的考查.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:解答题
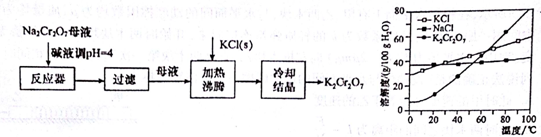
 Cr(OH)3+3H+,溶液中H+放电,c(H+)下降,平衡向右移动,使Cr3+形成Cr(OH)3沉淀;若电解后的溶液中c(Fe3+)为1.3×10-13mol/L,则溶液中Cr3+浓度为3.0×10-5mol/L.
Cr(OH)3+3H+,溶液中H+放电,c(H+)下降,平衡向右移动,使Cr3+形成Cr(OH)3沉淀;若电解后的溶液中c(Fe3+)为1.3×10-13mol/L,则溶液中Cr3+浓度为3.0×10-5mol/L.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
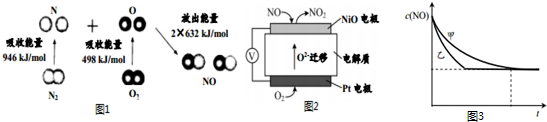
| 实验编号 | t (℃) | NO初始浓度 | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.2×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.2×10-3 | b | 124 |
| Ⅲ | 350 | a | 5.8×10-3 | 82 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al原子最外层电子数依次增多,其简单离子的氧化性依次增强 | |
| B. | P、S、Cl最高正化合价依次升高,对应的气态氢化物的稳定性依次增强 | |
| C. | C、N、O原子半径依次增大 | |
| D. | Na、K、Rb氧化物的水化物碱性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑤ | C. | ②⑤ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
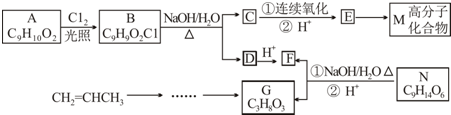
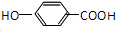 .
. .
.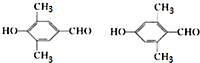 .
.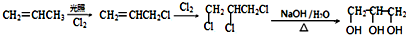 . (已知:CH2=CHCH3$→_{Cl_{2}}^{光照}$CH2=CHCH2Cl)
. (已知:CH2=CHCH3$→_{Cl_{2}}^{光照}$CH2=CHCH2Cl)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验次数编号 | 盐酸溶液体积V(mL) | 氢氧化钠溶液体积V(mL) |
| 1 | 19.90 | 10.00 |
| 2 | 20.10 | 10.00 |
| 3 | 22.00 | 10.00 |
| 4 | 20.00 | 10.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com