
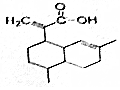
 有机物X可作为合成青蒿素的一种基本原料,已知X的结构如图,下列有关X的说法正确的是( )
有机物X可作为合成青蒿素的一种基本原料,已知X的结构如图,下列有关X的说法正确的是( )| A. | X为烃的含氧衍生物 | |
| B. | 1molX最多可以和3mol H2发生加成反应 | |
| C. | X只能发生取代反应和加成反应 | |
| D. | X可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且褪色原理相同 |
分析 该分子中含有碳碳双键和羧基,具有烯烃和羧酸的性质,能发生加成反应、加聚反应、氧化反应、还原反应、取代反应、酯化反应等.
解答 解:A.该物质中除了含有C、H元素外还含有O元素,所以属于烃的含氧衍生物,故A正确;
B.该分子中只有碳碳双键能和氢气在一定条件下发生加成反应,所以1molX最多可以和2mol H2发生加成反应,故B错误;
C.X中含有碳碳双键和羧基,还可以发生加聚反应、氧化反应、中和反应,故C错误;
D.X能和溴发生加成反应而使溴的四氯化碳溶液褪色,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,前者是加成反应、后者是氧化反应,所以二者褪色原理不同,故D错误;
故选A.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查烯烃和羧酸的性质,注意:酯化反应也属于取代反应.


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 第ⅠA族元素从上到下,单质的熔点逐渐降低 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较低 | |
| C. | 所有主族元素原子的最外层电子数都等于元素的最高正化合价 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 与NaOH水溶液共热,生成的有机物的结构简式为
与NaOH水溶液共热,生成的有机物的结构简式为 .
. ;若该有机物有一个反式异构体,且能与氢气加成生成2-甲基戊烷,则该有机物的结构简式为
;若该有机物有一个反式异构体,且能与氢气加成生成2-甲基戊烷,则该有机物的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 操作及现象 | 结论 | |
| A | 向PbSO4悬浊液中加入KI溶液时出现黄色沉淀 | Ksp(PbI2)<Ksp(PbSO4) |
| B | 向某溶液中滴加氯水后再加入稀C6H5OH溶液,溶液呈红色 | 原溶液中可能含有Fe2+ |
| C | 向Na2SiO3溶液中通入过量SO2气体 | 反应为:SiO${\;}_{3}^{2-}$+SO2+H2O=H2SiO3↓+SO${\;}_{3}^{2-}$ |
| D | 将氢气还原氧化铜所得的红色固体加入足量稀硝酸中,溶液变为蓝色 | 反应为:3Cu+2NO${\;}_{3}^{-}$+8H+=3Cu2++2NO↑+4H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
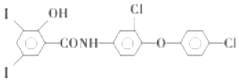
| A. | 与浓硫酸共热,有紫色气体产生 | B. | 分子中所有原子有可能在同一平面 | ||
| C. | 1mol只能与2molNaOH反应 | D. | 可使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “梨花淡自柳深青,柳絮飞时花满城”中柳絮的主要成分和棉花的相同 | |
| B. | 制作烟花的过程中常加入金属发光剂和发色剂烟花放出五彩缤纷的颜色 | |
| C. | 草莓棚中使用的“吊带式二氧化碳气肥”的主要成分可以是碳酸钙 | |
| D. | 《本草纲目》记载的“凡酸坏之酒,皆可蒸烧”的实验方法可用来分离乙酸和乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | 开始沉淀时的pH | 沉淀完全时的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |
| 物质 | 20℃时溶解性(H2O) |
| CaSO4 | 微溶 |
| NiF | 可溶 |
| CaF | 难溶 |
| NiCO3 | Ksp=1.0×10-6 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com