

| A.浓盐酸附近产生白烟:NH3与HCl气体反应产生了NH4C1固体 |
| B.浓硫酸附近无明显现象:NH3与浓硫酸不发生反应 |
| C.氯化物溶液变浑浊:该溶液一定是A1Cl3溶液 |
| D.湿润的红色石蕊试纸变蓝:NH3的水溶液显碱性 |
科目:高中化学 来源:不详 题型:实验题
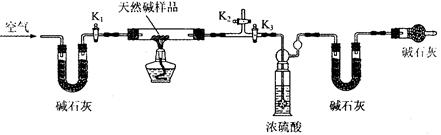
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
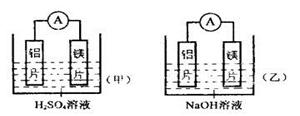
| A.利用原电池反应判断金属活动性顺序时应注意选择合适的电解质 |
| B.镁的金属性不一定比铝的金属性强 |
| C.该实验说明金属活动顺序表已过时,已设有实用价值 |
| D.该实验说明化学研究对象复杂、化学反应受条件影响较大,因此应具体问题具体分析 |
 xC(g) + D(g),反应达到平衡时C的浓度为1.2 mol/L,B的浓度为0.1 mol/L。
xC(g) + D(g),反应达到平衡时C的浓度为1.2 mol/L,B的浓度为0.1 mol/L。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
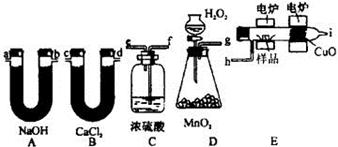
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
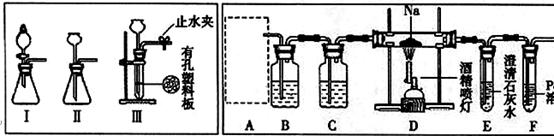
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
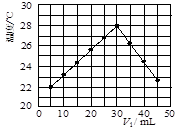
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
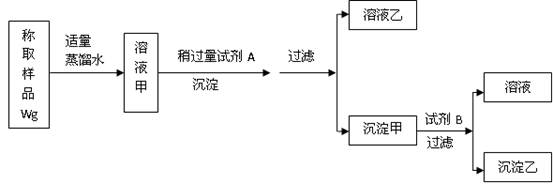
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com