
| A、氨水的浓度大于盐酸的浓度 |
| B、原氨水中有1%的含氮微粒为NH4+ |
| C、氨水中水电离出的c(H+)是盐酸中水电离出的c(H+)的100倍 |
| D、混合溶液中c(NH4+)+c(NH3?H2O)+c(NH3)=5×10-4mol/L |
| n |
| V |
| n |
| V |
| 0.001mol/L |
| 0.1mol/L |


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
| A、单质、原子、化合物 |
| B、元素、单质、化合物 |
| C、无机化合物、元素、有机化合物 |
| D、原子核、原子、分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| B、分别为7.8g的Na2S和Na2O2中含有的阴离子数分别是0.1NA和0.2NA |
| C、常温常压下,22.4L CO2中含有的CO2分子数小于NA个 |
| D、1L 0.1mol/L的氨水含有0.1NA个NH3?H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a mol/L的HCN溶液与b mol/L的NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b |
| B、常温,CH3COONa溶液的pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7mol/L |
| C、常温下,0.1mol/L的某酸溶液中,若c(OH-)/c(H+)=1×10-8,则溶液中由水电离出的c(H+)=1×10-11mol/L |
| D、在0.1mol/L的Na2SO3溶液中加入少量NaOH固体,c(SO32-)与c(Na+)均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中由水电离的氢离子浓度为1×10-11mol/L:K+、Na+、SO42-、NO3- |
| B、使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3- |
| C、0.1mol?L-1 AgNO3 溶液:H+、K+、SO42-、I- |
| D、0.1mol?L-1 NaAlO2 溶液:H+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 实验方案 | 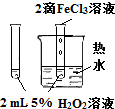 |
 将NO2球浸泡在冰水和热水中 |
 |
 |
| 实验 目的 |
验证FeCl3对H2O2分解反应有催化作用 | 探究温度对平衡 2NO2?N2O4的影响 |
除去CO2气体中混有的SO2 | 比较HCl、H2CO3和H2SiO3的酸性强弱 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D是短周期元素形成的四种气体单质.E、F均为气体,且F为红棕色.有关的转化关系如下图所示(反应条件均已略去).请回答下列问题:
A、B、C、D是短周期元素形成的四种气体单质.E、F均为气体,且F为红棕色.有关的转化关系如下图所示(反应条件均已略去).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸与氢氧化钡中和:H++OH-=H2O |
| B、碳酸氢钠的水解:HCO3-+H2O?H3O++CO32- |
| C、碳酸钠的水解:CO32-+2H2O?H2O+CO2+2OH- |
| D、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3 NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com