
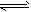 FeO(s)+CO(g) ��H1=a kJ/mol����CO(g)+1/2O2(g)
FeO(s)+CO(g) ��H1=a kJ/mol����CO(g)+1/2O2(g)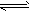 CO2(g) ��H2=b kJ/mol ����ڲ�ͬ�¶��£���Ӧ�ٵ�ƽ�ⳣ��Kֵ���¶ȵı仯����
CO2(g) ��H2=b kJ/mol ����ڲ�ͬ�¶��£���Ӧ�ٵ�ƽ�ⳣ��Kֵ���¶ȵı仯����
 Ϊ�������CO������TΪ�¶���T1> T2��
Ϊ�������CO������TΪ�¶���T1> T2�� 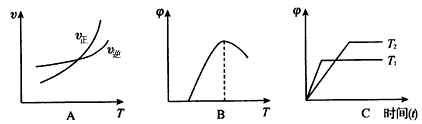
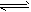 2FeO(s) ��H3���÷�Ӧ�ġ�H3=____kJ/mol��
2FeO(s) ��H3���÷�Ӧ�ġ�H3=____kJ/mol�� 
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��10�֣��跴Ӧ��Fe(s)+CO2(g)FeO(s)+CO(g) ��H = Q1��ƽ�ⳣ��ΪK1����Ӧ��Fe(s)+H2O(g)
FeO(s)+H2(g) ��H = Q2��ƽ�ⳣ��ΪK2���ڲ�ͬ�¶��£�K1��K2��ֵ���£�
| �¶�( T ) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
(1)���ϱ����ƶϣ���Ӧ����________(��š�������)�ȷ�Ӧ��
(2)���з�Ӧ��H2(g)+CO2(g)CO(g)+H2O(g) ��H = Q
�ٸ��ݷ�Ӧ������Ƶ���K1��K2��K3�Ĺ�ϵʽK3=_____________�����ƶϷ�Ӧ����________(��š�������)�ȷ�Ӧ��Ҫʹ��Ӧ����һ�������½�����ƽ�����ƣ��ɲ�ȡ�Ĵ�ʩ��__________��
A����С������� B�������¶� C��ʹ�ú��ʵĴ���
D���跨����CO���� E�������¶�
�ڸ��ݷ�Ӧ������Ƶ���Q1��Q2��Q3�Ĺ�ϵʽQ3 =_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�����ʡ��̶��ѧ������ѧ����ĩ���Ի�ѧ�Ծ����������� ���ͣ������
��12�֣�����������Ӧ��ij�ܱ������н��У�
��Ӧ�� Fe(s)+CO2(g) FeO(s)+CO(g) ��H1=" a" kJ��mol-1
FeO(s)+CO(g) ��H1=" a" kJ��mol-1
��Ӧ�� 2CO(g)+O2(g) 2CO2(g) ��H2=" b" kJ��mol-1
2CO2(g) ��H2=" b" kJ��mol-1
��Ӧ�� 2Fe(s)+O2(g) 2FeO(s) ��H3
2FeO(s) ��H3
��1�����H3= ���ú�a��b�Ĵ���ʽ��ʾ��
��2����֪500��ʱ��Ӧ�ٵ�ƽ�ⳣ��K=1.0���ڴ��¶���2L�ܱ������н��з�Ӧ�٣�Fe��CO2����ʼ����Ϊ2.0mol���ﵽƽ��ʱCO2��ת����Ϊ
��3��������ƽ����ϵ������700�棬�ٴδﵽƽ��ʱ��ϵ��CO��Ũ����CO2Ũ�ȵ���������
a 0���>������<����=������Ϊ�˼ӿ컯ѧ��Ӧ������ʹ��ϵ��CO�����ʵ������ӣ�������������ʱ�����Բ�ȡ�Ĵ�ʩ�� ������ţ���
| A����С��Ӧ����� | B����ͨ��CO2 |
| C�������¶� | D��ʹ�ú��ʵĴ��� |
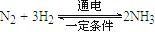 �����ڵ�ⷨ�ϳɰ��Ĺ����У�Ӧ����2���ϵ�ͨ�� ������������������� ������ ��������������һ�缫ͨ��N2���õ缫��ӦʽΪ ��
�����ڵ�ⷨ�ϳɰ��Ĺ����У�Ӧ����2���ϵ�ͨ�� ������������������� ������ ��������������һ�缫ͨ��N2���õ缫��ӦʽΪ ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ���㽭ʡ���ݵڶ���ѧ�߶���ѧ�����п��Ի�ѧ�Ծ����������� ���ͣ������
��10�֣���1����ӦFe(s)+CO2(g) FeO(s)+CO(g) ��H1��ƽ�ⳣ��ΪK1
FeO(s)+CO(g) ��H1��ƽ�ⳣ��ΪK1
��ӦFe(s)+H2O(g) FeO(s)+H2(g) ��H2��ƽ�ⳣ��ΪK2
FeO(s)+H2(g) ��H2��ƽ�ⳣ��ΪK2
�ڲ�ͬ�¶�ʱK1��K2��ֵ���±���
| | 700�� | 900�� |
| K1 | 1��47 | 2��15 |
| K2 | 2��38 | 1��67 |
 CO(g) + H2O(g) ��H��ƽ�ⳣ��K�����H= ���á�H1�͡�H2��ʾ����K= ����K1��K2��ʾ�����������������֪����ӦCO2(g) + H2(g)
CO(g) + H2O(g) ��H��ƽ�ⳣ��K�����H= ���á�H1�͡�H2��ʾ����K= ����K1��K2��ʾ�����������������֪����ӦCO2(g) + H2(g) CO(g) + H2O(g)�� ��Ӧ������ȡ����ȡ�����
CO(g) + H2O(g)�� ��Ӧ������ȡ����ȡ����� CO(g) + H2O(g)�ﵽ��ѧƽ��״̬�������� ������ţ���
CO(g) + H2O(g)�ﵽ��ѧƽ��״̬�������� ������ţ��� FeO(s)+CO(g) ��H > 0��CO2��Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��
FeO(s)+CO(g) ��H > 0��CO2��Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��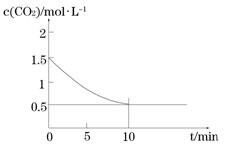
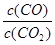 ������� ������ţ�
������� ������ţ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012��ɽ��ʡ�߶���ѧ�����п��Ի�ѧ�������Ծ� ���ͣ������
��10�֣��跴Ӧ��Fe(s)+CO2(g) FeO(s)+CO(g) ��H = Q1��ƽ�ⳣ��ΪK1����Ӧ��Fe(s)+H2O(g)
FeO(s)+CO(g) ��H = Q1��ƽ�ⳣ��ΪK1����Ӧ��Fe(s)+H2O(g) FeO(s)+H2(g) ��H = Q2��ƽ�ⳣ��ΪK2���ڲ�ͬ�¶��£�K1��K2��ֵ���£�
FeO(s)+H2(g) ��H = Q2��ƽ�ⳣ��ΪK2���ڲ�ͬ�¶��£�K1��K2��ֵ���£�
|
�¶�( T ) |
K1 |
K2 |
|
973 |
1.47 |
2.38 |
|
1173 |
2.15 |
1.67 |
(1)���ϱ����ƶϣ���Ӧ����________(��š�������)�ȷ�Ӧ��
(2)���з�Ӧ��H2(g)+CO2(g) CO(g)+H2O(g) ��H = Q
CO(g)+H2O(g) ��H = Q
�ٸ��ݷ�Ӧ������Ƶ���K1��K2��K3�Ĺ�ϵʽK3=_____________�����ƶϷ�Ӧ����________(��š�������)�ȷ�Ӧ��Ҫʹ��Ӧ����һ�������½�����ƽ�����ƣ��ɲ�ȡ�Ĵ�ʩ��__________��
A����С������� B�������¶� C��ʹ�ú��ʵĴ���
D���跨����CO���� E�������¶�
�ڸ��ݷ�Ӧ������Ƶ���Q1��Q2��Q3�Ĺ�ϵʽQ3 =_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010�꽭��ʡ��һ�ڶ�ѧ�����п��Ի�ѧ��ʵ��ࣩ���� ���ͣ������
��10�֣��跴Ӧ��Fe(s)+CO2(g)  FeO(s)+CO(g)��ƽ�ⳣ��ΪK1��
FeO(s)+CO(g)��ƽ�ⳣ��ΪK1��
��Ӧ��Fe(s)+H2O(g)  FeO(s)+H2(g)��ƽ�ⳣ��ΪK2���ڲ�ͬ�¶��£� K1��K2��ֵ���£�
FeO(s)+H2(g)��ƽ�ⳣ��ΪK2���ڲ�ͬ�¶��£� K1��K2��ֵ���£�
|
T(K) |
K1 |
K2 |
|
973 |
1.47 |
2.36 |
|
1173 |
2.15 |
1.67 |
��1��ƽ�ⳣ��K1�ı���ʽΪ ________________ ��
��2�����з�Ӧ�� CO2(g) +H2(g)  CO(g) +H2O(g);��H>0������һ�� ��������š��� �ȷ�Ӧ��Ҫʹ��Ӧ����һ�������½�����ƽ�������ƶ����ɲ�ȡ�Ĵ�ʩ����
��
CO(g) +H2O(g);��H>0������һ�� ��������š��� �ȷ�Ӧ��Ҫʹ��Ӧ����һ�������½�����ƽ�������ƶ����ɲ�ȡ�Ĵ�ʩ����
��
A.��С��Ӧ�����ݻ� B.����Ӧ�����ݻ� C.�����¶�
D.�����¶� E.ʹ�ú��ʵĴ��� F.�跨����CO����
��3������ӦFe(s)+CO2(g)  FeO(s)+CO(g)���¶�T1�½��У�Fe(s)+H2O(g)
FeO(s)+CO(g)���¶�T1�½��У�Fe(s)+H2O(g)
 FeO(s)+H2(g)���¶�T2�½��У���֪T1>T2����c(CO2)>c(CO)��������������ͬ���������ߵķ�Ӧ����
������ţ���
FeO(s)+H2(g)���¶�T2�½��У���֪T1>T2����c(CO2)>c(CO)��������������ͬ���������ߵķ�Ӧ����
������ţ���
A.ǰ�ߴ� B.���ߴ� C.һ���� D.���ж�
��4������ͼ��ͼ��vΪ���ʣ���Ϊ������İٷֺ�����TΪ�¶ȣ�
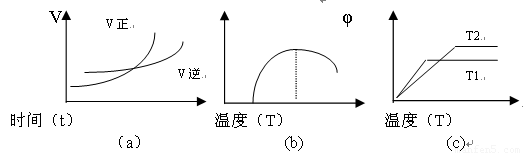
���з��Ϸ�Ӧ�ٵ��� _________ ����ͼ����ţ���ͬ�������Ϸ�Ӧ�ڵ��� ___ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com