
| A. | 随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大 | |
| B. | 碱金属元素中,锂原子失去最外层电子的能力最弱 | |
| C. | 钾与水的反应比钠与水的反应更剧烈 | |
| D. | 因为非金属性Cl>S,盐酸的酸性比氢硫酸强 |
分析 元素周期表中,同主族元素原子最外层电子数相同,具有相似的化学性质,从上到下,原子半径依次增大,金属性依次增强,非金属性依次减弱,可根据最高价氧化物的酸性、氢化物的稳定性等比较非金属性强弱,以此解答该题.
解答 解:A.同主族元素,从上到下,原子半径依次增大,故A正确;
B.同主族元素,从上到下,金属性依次增强,则锂原子失去最外层电子的能力最弱,故B正确;
C.钾排在钠的下面,金属性强于钠,与水反应比钠更剧烈,故C正确;
D.同周期元素,应根据最高价氧化物的水化物的酸性比较非金属性强弱,故D错误.
故选D.
点评 本题考查了碱金属、卤族元素性质,侧重于学生的分析能力的考查,题目难度不大,掌握同主族元素性质的递变规律是解题的关键.


 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图,曲线为可逆反应A(g)+2B(g)?2C(g) 正反应为吸热反应的平衡移动关系曲线,下列说法正确的是( )
如图,曲线为可逆反应A(g)+2B(g)?2C(g) 正反应为吸热反应的平衡移动关系曲线,下列说法正确的是( )| A. | a<b,y轴指B的质量分数 | B. | a>b,y轴指C的质量分数 | ||
| C. | a<b,y轴指A的转化率 | D. | a>b,y轴指A的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | ||
| C. | 2MgO$\frac{\underline{\;\;△\;\;}}{\;}$2Mg+O2↑ | D. | MgCl2$\frac{\underline{\;电解\;}}{熔融}$Mg+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物可能含共价健 | |
| B. | 离子化合物中一定不含共价键,阳离子只能是金属离子 | |
| C. | 共价化合物可能含离子键 | |
| D. | 有化学键断裂就一定有化学键形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氢氧燃料电池工作时,H2在负极上失去电子 | |
| B. | 0.1mol/LNa2CO3溶液加热后,溶液的PH减小 | |
| C. | 中和滴定时,滴定管用所盛装的反应液润洗2〜3次 | |
| D. | 室温下,稀释0.1mol/LCH3COOH溶液,溶液的导电能力增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.9g | B. | 4.5g | C. | 9.0mol | D. | 13.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
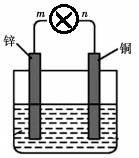 将质量均为100g的锌片和铜片用导线与灯泡串联浸入盛有500mL 2mol•L-1稀硫酸溶液的1.5L容器中构成如图装置.
将质量均为100g的锌片和铜片用导线与灯泡串联浸入盛有500mL 2mol•L-1稀硫酸溶液的1.5L容器中构成如图装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com