
| A. | 1mol H2O的质量为18g/mol | |
| B. | 常温常压下,0.05NA个CO2分子所占的体积是1.12L | |
| C. | 3.01×1023个SO2分子的质量为32g | |
| D. | 标准状况下2gO2与3gO3所含原子个数相等 |
分析 A、质量单位是g;
B、常温常压下,Vm≠22.4L/mol;
C、根据公式m=nM=$\frac{N}{{N}_{A}}$M来计算;
D、根据公式m=nM=$\frac{N}{{N}_{A}}$M来计算.
解答 解:A、1mol H2O的质量为18g,故A错误;
B、标准状态下,0.05NA个即0.05molCO2分子所占的体积是V=nVm=1.12L,此时Vm=22.4L/mol,但是常温常压下,Vm≠22.4L/mol,此时体积不是1.12L,故B错误;
C、3.01×1023个SO2分子的质量为$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}}$×64g/mol=32g,故C正确;
D、2gO2与3gO3所含原子个数之比是:$(\frac{2}{32}×2):(\frac{3}{48}×3)$≠1:1,即含有的氧原子数不相等,故D错误.
故选C.
点评 本题考查阿伏伽德罗常数、物质的量的有关计算等知识,注意标准状况下的条件,本题难度不大.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验内容 | 现象或结论 |
| A | 向2SO2+O2?2SO3的平衡体系中加入由18O构成的氧气 | 则SO2中的18O的含量会增加 |
| B | 以石墨为电极,电解KI溶液(其中含有少量酚酞) | 阴极逸出气体且附近溶液呈现红色 |
| C | FeCl3+3KSCN?Fe(SCN)3+3KCl 平衡体系中加入少量KSCN固体,溶液颜色加深 | 恒温时增大反应物浓度,平衡向正反应方向移动 |
| D | 向pH=1的盐酸和醋酸各0.5L的溶液中各加入1.4g铁粉 | 醋酸中生成H2的速率快且最终气体量多 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
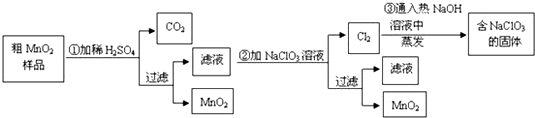
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某温度下,在体积为1L的密闭容器中,存在如下关系:xHF(g)?(HF)x(g),反应物和生成物的物质的量随时间变化关系如图.下列说法错误的是( )
某温度下,在体积为1L的密闭容器中,存在如下关系:xHF(g)?(HF)x(g),反应物和生成物的物质的量随时间变化关系如图.下列说法错误的是( )| A. | x=2 | |
| B. | 平衡时混合气体的平均摩尔质量是23.3g/mol | |
| C. | 该温度下,反应的平衡常数为0.25 L•mol-1 | |
| D. | t1时刻,保持恒温恒容,再充入1mol HF(g),重新达到平衡时,$\frac{c[(HF)_{x}]}{c(HF)}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣小组的同学用如图所示装置研究有关电化学的问题,当闭合该装置的电键时,观察到电流的指针发生了偏转.
某兴趣小组的同学用如图所示装置研究有关电化学的问题,当闭合该装置的电键时,观察到电流的指针发生了偏转.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发太阳能、水能、风能、地热能等新能源 | |
| B. | 大力开采煤、石油和天然气,以满足人们日益增长的能源需求 | |
| C. | 大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源 | |
| D. | 减少资源消耗,注重资源的重复使用、资源的循环再生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com