
【题目】化学与生活息息相关,下列说法不正确的是
A. 用食醋可除去热水壶内壁的水垢
B. 医用酒精的浓度通常为95%
C. 烹鱼时加适量醋和酒可以增加香味
D. 碘盐中的碘不可以直接用淀粉检验
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产和生活中使用非常广泛.
I、NaNO2外观和食盐相似,又有咸味,容易使人误食中毒.已知NaNO2能发生如下反应:
2NaNO2+4HI═2NO↑+I2+2NaI+2H2O.
(1)上述反应中用单线桥标出电子转移的方向和数目.
(2)某厂废液中,含有2%~5%的NaNO2 , 直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是 .
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(3)II.过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.根据下列反应回答问题:
A.Na2O2+2HCl═2NaCl+H2O2
B.Ag2O+H2O2═2Ag+O2↑+H2O
C.2H2O2═2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH═2K2CrO4+3K2SO4+8H2O
上述反应中,H2O2仅体现氧化性的反应是(填序号)
(4)上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序是
(5)某酸性反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、MnO4﹣、H2O、Mn2+、H2O2、H+ . 已知该反应中H2O2只发生了如下过程:H2O2→O2 .
①将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中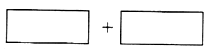
②如果上述反应中有6.72L(标准状况)气体生成,转移的电子为 mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠在供氧、防腐、除臭、微量分析等多方面有着重要用途,工业生产过氧化钠的方法是先将除去二氧化碳的干燥空气通入熔融的钠(温度453~473K) 中得到氧化钠,然后增加空气流量并迅速升高温度至573~673K 即可得到过氧化钠。某化学兴趣小组在实验室模拟工业流程制备过氧化钠,请回答下列相关问题。
(1)结合下图所示装置写出仪器连接顺序。

空气→______→______→______→______→______。(填导管口序号)_____________
(2)升温后发生的主要反应的化学方程式是_____________。
(3)下列选项中的加热方式适合该实验的是_____________(填选项序号)。
A.电炉 B.水浴 C.酒精喷灯 D.油浴(100-260℃ )
(4)若要提高产品纯度,需在具支试管后添加一个装置,该装置应该是_____________,其作用是_____________。
(5)实验中使用的钠的质量为4.600g,最终所得产品的质量为8.320g,通过仪器检测发现产品中含有少量NaN3,则该实验所得产品的产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生产、生活密切相关。下列做法值得提倡的是( )
A.小苏打用作净水剂B.饮高度酒预防新冠肺炎
C.漂粉精作食品漂白剂D.“地沟油”加工为生物燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究过氧化納与浓盐酸反应的产物,某研究性学习小组设计了如图所示的实验装置. 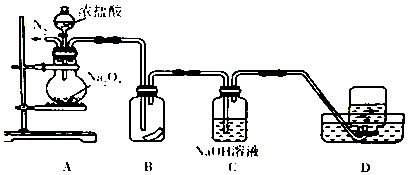
回答下列问题:
(1)实验开始前,必须进行的实验操作是、 .
(2)实验过程中装置B中湿润的有色布条褪色,说明生成的气体中有生成,说明Na2O2有性.
(3)装置C的主要作用是 , 反应的离子方程式为 .
(4)为证明装置D中收集到的无色气体是氧气,应进行的实验操作是 .
(5)过氧化钠与浓盐酸发生反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的两块钠,第一块在足量氧气中加热,第二块在足量氧气(常温)中充分反应,则下列说法正确的是( )
A.第一块钠失去电子多
B.两块钠失去电子一样多
C.第二块钠的反应产物质量最大
D.两块钠的反应产物质量一样大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉中加入少量稀硫酸,并加热。为了确定淀粉是否已水解或完全水解,需要①NaOH溶液;②银氨溶液;③新制Cu(OH)2碱性悬浊液;④碘水;⑤BaCl2中的
A.①⑤B.②④C.②③④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近研制出可望成为高效火箭推进剂的N(NO2)3,下列有关N(NO2)3分子的说法正确的是:
A. 该物质是只含共价键的共价化合物 B. 该物质中既含共价键也含离子键
C. 该物质是离子化合物 D. 该物质的组成微粒是阴阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.联氨(N2H4,常温下是无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)已知12.8 g的液态高能燃料联氨在氧气中燃烧,生成气态N2和液态水,放出248.8kJ的热量。写出表示液态联氨燃烧热的热化学方程式___________________。
(2)已知①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH4=-1048.9kJ/mol
上述反应热效应之间的关系式为ΔH4=___________,联氨和N2O4可作为火箭推进剂的主要原因为_____________。
Ⅱ.现有反应:mA(g)+nB(g)![]() pC(g).达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g).达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_______热反应,且m+n_____p(填“>”“=”“<”)。
(2)若加入B(体积不变),则A的转化率______,B的转化率____(填“增大”“减小”或“不变”)。
(3)若升高温度,则平衡时B、C的浓度之比![]() 将_________。
将_________。
(4)若加入催化剂,平衡时气体混合物的总物质的量_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com