
【题目】将足量的新制氯水分别滴加到下列溶液或滤纸上,对所观察到的现象描述合理的一组是
AgNO3溶液 | 蓝色石蕊试纸 | Na2CO3溶液 | |
A | 产生沉淀 | 变红后无现象 | 有气泡 |
B | 无明显现象 | 变红后无现象 | 产生沉淀 |
C | 产生沉淀 | 先变红后褪色 | 有气泡 |
D | 产生沉淀 | 先变红后褪色 | 产生沉淀 |
A.AB.BC.CD.D
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】酪氨酸是一种生命活动不可缺少的氨基酸,它的结构简式如下:
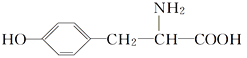
(1)酪氨酸能发生的化学反应类型有________(填字母)。
A.取代反应 B.氧化反应
C.酯化反应 D.中和反应
(2)在酪氨酸的同分异构体中,同时满足如下三个条件的,除酪氨酸外还有________种。
①属于氨基酸且“碳骨架”与酪氨酸相同;②与氯化铁溶液能发生显色反应;③氨基(—NH2)不与苯环直接相连。
(3)已知氨基酸能与碱反应,写出酪氨酸与足量的NaOH溶液反应的化学方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到化学平衡状态的标志是( )
2AB(g)达到化学平衡状态的标志是( )
A. 容器内A2、B2、AB三种气体的浓度相等
B. 单位时间内有a mol A2生成,同时就有amolB2消耗
C. 容器内气体的总质量不随时间变化而变化
D. 单位时间内有b molB2消耗,同时就有b molAB被分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的消毒剂,可用ClO2为原料制取。某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
已知:饱和NaClO2溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时 NaClO2分解成NaClO3和NaCl。Ba(ClO2)2可溶于水。
利用图所示装置进行实验。
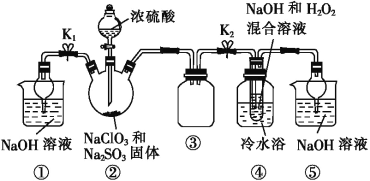
(1)装置①的作用是___________________,装置③的作用是________________。
(2)装置②中制备ClO2的化学方程式为___________________________;装置④中反应生成NaClO2的化学方程式为_____________________。
(3)从装置④反应后的溶液中获得NaClO2晶体的操作步骤为:①减压,55 ℃蒸发结晶;②趁热过滤;③__________________;④低于60 ℃干燥,得到成品。如果撤去④中的冷水浴,可能导致产品中混有的杂质是______________。
(4)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象是取少量晶体溶于蒸馏水,__________________________________________________________。
(5)为了测定NaClO2粗品的纯度,取10.0 g上述初产品溶于水配成1 L溶液,取出10 mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20 mol·L-1的Na2S2O3标准液滴定,重复2次,平均消耗Na2S2O3溶液20.00 mL,计算得NaClO2粗品的纯度为_____。(提示:2Na2S2O3+I2=Na2S4O6+2NaI)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4有关制备途径及性质如图所示。下列说法不正确的是 ( )
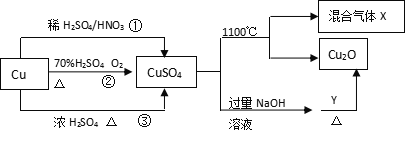
A. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2
B. 相对于途径①、③,途径②更好地体现了绿色化学思想
C. 1molCuSO4在1100℃所得混合气体X中O2可能为0.75mol
D. Y可能具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeC13、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是
A.溶液中一定不含Cu2+B.溶液中一定含Fe2+
C.加入KSCN溶液一定不变红色D.剩余固体中可能含有Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、砷化镓(GaAs)太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)镓元素位于元素周期表的____周期_____族,砷原子核外的电子有___种运动状态。
(2)Si、P、S 的第一电离能由大到小的顺序是 _____________, 二氧化硅和干冰晶体的熔点差别很大,其原因是________________________________________________。
(3)与AsF3互为等电子体的分子为___________(只写一中),其空间构型为_________。
(4)硼酸(H3BO3)本身不能电离出H+,在水溶液中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为______________。
②[B(OH)4]-的结构式为________________。
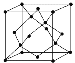
(5)金刚石的晶胞如图所示,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。
①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是________________(用化学式表示);
②金刚石的晶胞参数为a pm(1 pm=10-12 m)。 金刚石晶胞的密度为_________g/cm3(只要求列算式,阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300mLAl2(SO4)3溶液中,含Al3+质量为16.2g,在该溶液中加入![]()
![]() 溶液300mL,反应后溶液中SO42-的物质的量浓度为(忽略溶液混合体积的变化)
溶液300mL,反应后溶液中SO42-的物质的量浓度为(忽略溶液混合体积的变化)
A. 0.4mol/L B. 0.3mol/L C. 0.2mol/L D. 0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值, 下列说法正确的是( )
A. 常温下,将5. 6g铁片投入足量浓硝酸中生成6. 72L NO2气体
B. 1mol苯乙烯(![]() )分子中含有碳碳双键的个数为4 NA
)分子中含有碳碳双键的个数为4 NA
C. 标准状况下,11.2L的二氯甲烷所含的分子数为0. 5NA
D. 常温常压下,28g由C2H4和C3H6组成的混合物中,H原子的数目为4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com