
【题目】某实验小组拟用小颗粒状铝硅合金与足量稀硫酸的反应(已知硅与稀硫酸不反应),测定通常状况(20℃,101kPa)下的气体摩尔体积.拟选用下列实验装置完成实验: 
(1)该小组同学必须选用的装置依次连接的合理顺序为A、 .
(2)实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,开始时稀硫酸能滴人锥形瓶中, 一段时间后稀硫酸不能顺利滴人锥形瓶中,其原因是
(3)金属铝与稀硫酸反应的离子方程式为
(4)实验结束时,测量实验中生成H2体积的操作方法是
(5)实验中准确测得3个数据:实验前铝硅合金的质量m1g,实验后残留固体的质量m2g,实验后量筒中液面读数为V mL.则通常状况下气体摩尔体积Vm=
L/mol.若合金中含少量铜,则所测得的Vm将(填“偏大”“偏小”或“无影响”).
【答案】
(1)E、D、G
(2)铝与稀硫酸反应生成气体且放热,使锥形瓶内压强增大
(3)2Al+6H+=2Al3++3H2↑
(4)待实验装置冷却后,上下移动量筒使其中液面与广口瓶中液面相平,再平视读取量筒中水的体积,即氢气在通常状况时的体积;
(5)![]() ;无影响
;无影响
【解析】解:(1)①装置的组装顺序:合金与水反应,用排水量气法测定氢气的体积,其中盛水的试剂瓶导管一定要短进长出,利用增大压强原理将水排出,量筒中水的体积就是生成氢气的体积,量筒内导管应伸入量筒底部,故连接顺序为:E、D、G;所以答案是:E、D、G;(2)镁、铝与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大,导致硫酸不能顺利滴入锥形瓶;所以答案是:铝与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大;(3)金属铝与稀硫酸反应的离子方程式为2Al+6H+=2Al3++3H2↑,所以答案是:2Al+6H+=2Al3++3H2↑;(4)根据气压原理,待实验装置冷却后,上下移动量筒使其中液面与广口瓶中液面相平,再平视读取量筒中水的体积,此时的体积即为常温常压下的体积,即氢气在通常状况时的体积,所以答案是:待实验装置冷却后,上下移动量筒使其中液面与广口瓶中液面相平,再平视读取量筒中水的体积,即氢气在通常状况时的体积;(5)实验前铝硅合金的质量m1 g,实验后残留固体的质量m2 g,则金属铝的质量是m1﹣m2 , 实验后量筒中液面读数为VmL,即产生的气体物质的量是 ![]() ,根据化学反应原理:
,根据化学反应原理:
2Al~3H2↑
2 3 ![]()
![]()
解得Vm= ![]() LmoL﹣1 , 若合金中含有金属铜,不会和硫酸之间反应,和含有硅是一样的结果,
LmoL﹣1 , 若合金中含有金属铜,不会和硫酸之间反应,和含有硅是一样的结果,
所以答案是: ![]() ;无影响.
;无影响.


科目:高中化学 来源: 题型:
【题目】向含S2-、Fe2+、Br-、I-各0.1mol的溶液中通入Cl2,通入Cl2的体积(标准状况)和溶液中相关离子的物质的量关系图正确的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 液态HCl不导电,所以HCl是非电解质
B. NH3、CO2的水溶液能导电,所以NH3、CO2是电解质
C. 铜、石墨均能导电,所以它们都是电解质
D. 蔗糖在水溶液中或熔融时均不导电,所以是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列关于H2S和SO2的说法正确的是______________
A.两气体都可用浓硫酸干燥
B.两气体均可以用NaOH溶液吸收
C.两气体按体积比1:2 混合可完全转化为S
D.将两气体通入溴水或酸性KMnO4溶液中,可通过颜色变化鉴别两气体
(2)目前治理汽车尾气是在催化剂条件下发生反应2NO+2CO![]() N2+2CO2,现在实验室模拟上述反应,己知在t℃时在2L恒容密闭容器中加入2 molNO和1mol CO气体,经l0min达到平衡,测得此时CO2的体积分数为1/7,回答下列问题:
N2+2CO2,现在实验室模拟上述反应,己知在t℃时在2L恒容密闭容器中加入2 molNO和1mol CO气体,经l0min达到平衡,测得此时CO2的体积分数为1/7,回答下列问题:
①这段时间内CO的反应速率为_________________ 。
②该反应平衡常数______________(保留两位有效数字)。
③平衡后再向密闭容器通入0.4molCO和0.4molCO2,平衡将_____________(填“正向”、“逆向”或“不”)移动。判断理由是_________________。
④若升温发现体系气体平均相对分子质量增大,则该反应的△H______0(填“>”、“<”或“=”)。
⑤维持条件不变,向平衡后的容器再充入0.2molNO和0.1molCO,达到新平衡,则与原平衡相比NO的转化率____________ (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程或现象与盐类水解无关的是 ( )
A. 纯碱溶液去油污 B. 粗盐在空气中易潮解
C. 加热氯化铁溶液颜色变深 D. 浓硫化钠溶液有臭味
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,某NaOH稀溶液中c(H+)=10a mol/L,c(OH)=10b mol/L,已知a+b=12,请回答下列问题:
(1)该温度下水的离子积常数KW=__________________。
(2)NaOH的物质的量浓度为_________________,由水电离出的c(OH)为______________。
(3)给该NaOH溶液降温,pH________(填“变大”、“变小”或“不变”)。
(4)该温度下,将pH=3的H2SO4与pH=11的NaOH等体积混合,则混合后溶液的pH=____(已知lg2=0.3) (忽略溶液体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示
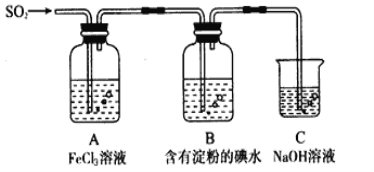
请按要求回答下列问题
(1)下列实验方案适用于在实验室制取所需SO2的是_______。
A. Na2SO3溶液与HNO3 B. Na2SO3固体与浓硫酸
C. 固体硫在纯氧中燃烧 D.铜与热浓硫酸
(2)装置C的作用是____________。如果有560mL SO2气体(已折算为标态)进入C装置中,则C中50mL NaOH溶液的物质的量浓度至少为____________mol/L才能达到目的。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:加热浓缩、冷却结晶、________、洗涤、自然干燥。在这一系列操作中没有用到的仪器有(填序号)____。
A.蒸发皿 B.分液漏斗 C.漏斗 D.玻璃棒 E.冷凝管
(4)在上述装置中通入过量的SO2,请设计实验验证SO2与Fe3+发生了氧化还原反应________________。
(5)本实验中能表明SO2的还原性比I-的还原性强的现象是__________________,其反应的离子方程式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com