
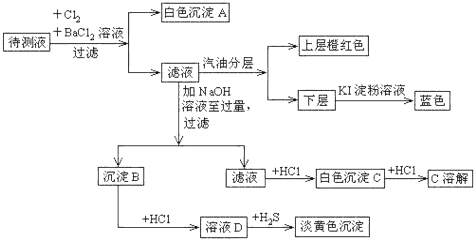
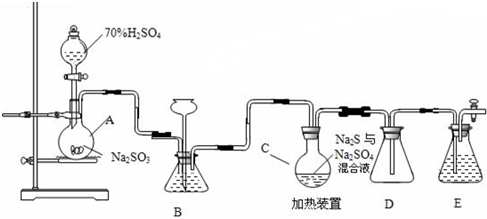
分析 先推断离子,加氯气和氯化钡生成白色沉淀,故A为硫酸钡沉淀,所以原溶液可能含亚硫酸根离子或硫酸根离子;由分层后的液体颜色说明原溶液含溴离子,加过量氢氧化钠沉淀B,再加盐酸溶解后和硫化氢反应出现淡黄色沉淀,说明原溶液含亚铁离子,由于SO32-与Fe2+、Cu2+、Mg2+会发生反应生成沉淀,所以原溶液不含亚硫酸根离子,故一定含硫酸根离子;滤液加盐酸先沉淀后溶解,说明原溶液含铝离子;以上推断可看出,一定含Fe2+、Al3+、Br-、SO42-,根据以上分析回答即可.
解答 解:先推断离子,加氯气和氯化钡生成白色沉淀,故A为硫酸钡沉淀,所以原溶液可能含亚硫酸根离子或硫酸根离子;由分层后的液体颜色说明原溶液含溴离子,加过量氢氧化钠沉淀B,再加盐酸溶解后和硫化氢反应出现淡黄色沉淀,说明原溶液含亚铁离子,由于SO32-与Fe2+、Cu2+、Mg2+会发生反应生成沉淀,所以原溶液不含亚硫酸根离子,故一定含硫酸根离子;滤液加盐酸先沉淀后溶解,说明原溶液含铝离子;以上推断可看出,一定含Fe2+、Al3+、Br-、SO42-.
(1)溶液中肯定有的离子是Br-、Al3+、Fe2+、SO42-,故答案为:Br-、Al3+、Fe2+、SO42-;
(2)溶液中存在铝离子,所以一定不存在碳酸根离子,因为二者之间发生双水解反应不能大量共存,故答案为:无,与Al3+发生双水解反应不能大量共存;
(3)由以上分析可知一定含亚铁离子,镁离子不能确定是否存在,故沉淀B一定含氢氧化铁,可能含氢氧化镁,铁离子具有氧化性,能将还原性的物质氧化,得到淡黄色的沉淀硫单质,即发生反应:2Fe3++H2S=2Fe2++S↓+2H+,故答案为:Fe(OH)3;2Fe3++H2S=2Fe2++S↓+2H+.
点评 本题考查了离子的推断,中等难度,要根据特征现象来推断离子的存在,注意知识的归纳和梳理是解题的关键.


科目:高中化学 来源: 题型:填空题
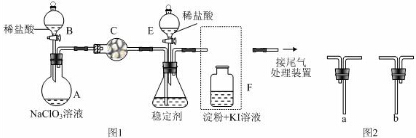 ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究.
ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol丙烯酸含有NA个不饱和键 | |
| B. | 标准状况下,11.2L的苯中含有3NA个碳氢键 | |
| C. | 0.1mol/L的Na3PO4溶液中含有的阴离子总数大于0.1NA | |
| D. | 1L1.0mol/L的Na2SiO3溶液中含有的氧原子数目大于3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
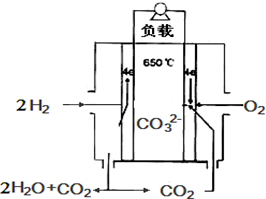 熔融碳酸盐燃料电池,是由多孔陶瓷阴极、多孔陶瓷电解质隔膜、多孔金属阳极、金属极板构成的燃料电池.其电解质是熔融态碳酸盐.如图是用熔融碳酸盐作电解质,氢气和氧气形成的燃料电池,下列说法不正确的是( )
熔融碳酸盐燃料电池,是由多孔陶瓷阴极、多孔陶瓷电解质隔膜、多孔金属阳极、金属极板构成的燃料电池.其电解质是熔融态碳酸盐.如图是用熔融碳酸盐作电解质,氢气和氧气形成的燃料电池,下列说法不正确的是( )| A. | 该电池放电时,负极的反应式为:H2-2e-+CO32-═H2O+CO2 | |
| B. | 该电池中CO32-的为由左边移向右边移动 | |
| C. | 该电池放电时,正极的反应式为:O2+2CO2+4e-═2CO32- | |
| D. | 该电池放电时,当转移4mol e-时正极消耗1mol O2和2mol CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灯光变暗;二者电离常数相同 | B. | 灯光变暗;电离常数醋酸大于氨水 | ||
| C. | 灯光变亮;电离常数醋酸小于氨水 | D. | 灯光变亮;电离常数醋酸等于氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 1mol/L NaHCO3溶液中自由移动的离子总数为3NA | |
| B. | 常温常压下,1.06g Na2CO3含有Na+数目为0.02NA | |
| C. | 1 mol Na2O2与CO2反应电子转移为2 NA | |
| D. | 40g NaOH溶解在1 L水中,得到溶液的物质的量浓度为1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
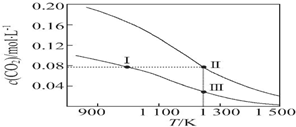
| A. | 反应CO2(g)+C(s)═2CO(g)的△S>0、△H<0 | |
| B. | 体系的总压强p总:p总(状态Ⅱ)>2p总(状态Ⅰ) | |
| C. | 体系中c(CO):c(CO,状态Ⅱ)>2c(CO,状态Ⅲ) | |
| D. | 逆反应速率v逆:v逆(状态Ⅰ)>v逆(状态Ⅲ) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com