
| 周期 族 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
| 4 | ⑩ |
 ,故答案为:
,故答案为: ;
;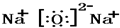 ,故答案为:Al;
,故答案为:Al;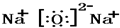 ;
;

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源: 题型:
 某化学反应2A(g)
某化学反应2A(g)| 催化剂 |
| 实验 序号 |
温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | 1.0 | 0.85 | 0.71 | 0.68 | 0.58 | 0.50 | 0.50 |
| 3 | 820℃ | 2.0 | 0.90 | 0.65 | 0.60 | 0.60 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验步骤 | 实验现象及结论 |
| 将晶体混合,立即快速搅拌 | 有刺激性气味能使湿润的紫色石蕊试纸变蓝的 |
| 用手摸烧杯下部 | 感觉烧杯变凉说明此反应是 |
| 用手拿起烧杯 | 烧杯下面的带有几滴水的玻璃片粘到了烧杯底部 |
| 将粘有玻璃片的烧杯放在盛有热水的烧杯上 | 玻璃片脱离上面烧杯底部 |
| 反应后移走多孔塑料片观察反应物 | 混合物成糊状,证明有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA |
| B、标准状况下,22.4LH2O 含有的水分子数为NA |
| C、通常状况下,NA个CO2分子占有的体积为22.4L |
| D、物质的量浓度为0.5mol/L的MgCl2溶液中含有Cl-个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、电路中通过电子
| ||
B、n=
| ||
C、溶液中H+增加
| ||
D、n=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 |
| B、用盐酸标准溶液滴定待测的氢氧化钠溶液时,酸式滴定管尖嘴处开始有气泡,滴后气泡消失,会使测定结果偏低 |
| C、用湿润pH试纸测溶液pH时,应用滴管取液滴在试纸上,再与标准比色卡对比 |
| D、取a克Na2CO3和NaHCO3混合物于锥形瓶中加适量水溶解,酚酞作指示剂,用c mol?L-1的标准盐酸滴定,可测定混合物中Na2CO3的质量分数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com