
| A.在pH=11的溶液中,水电离出的c(OH-)一定等于10-3 mol/L |
| B.将pH=1的酸和pH=13的碱溶液等体积混合后,溶液的pH一定等于7 |
| C.将物质的量浓度和体积都相同的一元酸HA与一元碱BOH混合后,溶液呈中性,则反应后溶液中c(H+)= |
| D.若强酸、强碱中和后溶液的pH=7,则中和之前酸、碱的pH之和一定等于14 |
科目:高中化学 来源:不详 题型:填空题
 表示这一反应_____________________。
表示这一反应_____________________。 ?H3O++OH-,液氨类似于水的电离,试写出液氨的电离方程式________________________;在液氨中加入NH4Cl,则平衡将向________移动(填“正反应方向”或“逆反应方向”)。
?H3O++OH-,液氨类似于水的电离,试写出液氨的电离方程式________________________;在液氨中加入NH4Cl,则平衡将向________移动(填“正反应方向”或“逆反应方向”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
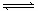 H++OH— △H>0,下列叙述正确的是( )
H++OH— △H>0,下列叙述正确的是( )| A.向水中加入稀氨水,平衡逆向移动,c(OH—)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加入少量固体NaOH,平衡逆向移动,c(OH—)降低 |
| D.将水加热,Kw增大,c(H+)不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 序号 | Ba(OH)2溶液体积/mL | 盐酸体积/mL | 混合液pH |
| 1 | 22.00 | 0 | 10 |
| 2 | 22.00 | 18.00 | 9 |
| 3 | 22.00 | 22.00 | 8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.404 KJ/mol | B.260 KJ/mol | C.230 KJ/mol | D.200 KJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1×10-4 mol·L-1 | B.1×10-8 mol·L-1 |
| C.1×10-11 mol·L-1 | D.1×10-10 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com