
| A. | CO2的电子式: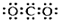 | B. | Na+的结构示意图: | ||
| C. | 氯离子:Cl | D. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl |
分析 A.二氧化碳为共价化合物,分子中含有两个碳氧双键;
B.钠离子的核电荷数为11,核外电子总数为10,最外层达到8电子稳定结构;
C.氯离子为阴离子,带有一个单位负电荷;
D.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数.
解答 解:A.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,故A错误;
,故A错误;
B.钠离子的核电荷数为11,最外层满足8电子稳定结构,其正确的离子结构示意图为: ,故B错误;
,故B错误;
C.氯离子带有1个单位负电荷,其正确的表示方法为:Cl-,故C错误;
D.氯原子的质子数为17,中子数为20的氯原子的质量数为37,该原子可以表示为:${\;}_{17}^{37}$Cl,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及电子式、离子结构示意图、元素符号等知识,明确常见化学用语的书写原则为解答关键,试题侧重考查学生的规范答题能力.


科目:高中化学 来源: 题型:推断题
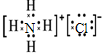
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | D>B>A>C | C. | B>A>C>D | D. | C>A>B>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向带有氧化膜的铝片中加入盐酸 | |
| B. | 向NaHCO3溶液中加入一定质量的Na2O2粉末 | |
| C. | 向漂白粉浊液中通入过量CO2 | |
| D. | 向NaOH溶液中加入过量AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL-1 | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL-1 | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL-1 | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的离子积常数量KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度 | |
| B. | Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关 | |
| C. | 常温下,在0.10 mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH4+)/c(NH3•H2O)的值增大 | |
| D. | 室温下,CH3COOH的KW=1.7×10-5,NH3•H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3•H2O中的c(OH-)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “84”消毒液的水溶液中:Fe2+、Cl-、H+、Na+ | |
| B. | 加入KSCN显红色的溶液:K+、NH4+、Cl-、S2- | |
| C. | 无色溶液中:K+、CH3COO-、HCO3-、MnO4- | |
| D. | pH=2的溶液中:NH4+、Na+、Cl-、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 热化学方程式 | 结 论 | |
| A. | 2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol | 氢气的燃烧热△H=-483.6 kJ/mol |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l) △H=-57.3 kJ/mol | 含40.0g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3kJ |
| C. | 2C(s)+2O2(g)═2CO2(g)△H=-a kJ/mol 2C(s)+O2(g)═2CO(g)△H=-b kJ/mol | b>a |
| D. | C (石墨,s)═C (金刚石,s)△H=+1.5 kJ/mol | 金刚石比石墨稳定 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com