
 某兴趣小组设计了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.
某兴趣小组设计了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.分析 (1)①根据反应装置、气体收集装置的特点选择;
②根据二氧化氮的性质选取试剂;
(2)①根据氯气和溴之间的置换反应判断氧化性强弱,并写出相应的离子方程式;
②根据碳化钙和水的反应写出相应的方程式;根据乙炔与溴水或酸性高锰酸钾反应的现象判断;
(3)根据球形干燥管的特点分析.
解答 解:(1)①根据I装置知,反应物反应时不需加热,所以D排除;根据Ⅱ装置知,反应生成的气体密度小于空气的密度,所以排除B,符合条件的是AC,
故答案为:AC;
②二氧化氮能和水反应,所以不能用排水法收集,可将Ⅱ装置加满(难挥发的)有机溶剂来收集二氧化氮气体.
故答案为:将Ⅱ装置加满(难挥发的)有机溶剂;
(2)①氯气能和溴化物置换出溴单质Cl2+2Br-=2Cl-+Br2,从而确定氯气的氧化性大于溴的氧化性,
故答案为:Cl2+2Br-=2Cl-+Br2;
②碳化钙和水反应生成氢氧化钙和乙炔,CaC2+2H2O→Ca(OH)2+C2H2↑;溴或酸性高锰酸钾有强氧化性,能氧化乙炔,所以乙炔能使溴水或高锰酸钾溶液褪色,
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;溴水褪色或高锰酸钾溶液褪色;
(3)因为当气体被吸收时,液体上升到球形管中.由于球形管容积较大,导致试管中液面明显下降,使球形管口脱离液面,球形管中的液体又流回试管中,从而防止了倒吸,
故答案为:当气体被吸收时,液体上升到球形管中,由于球形管容积较大,导致试管中液面明显下降,使球形管口脱离液面,球形管中的液体又流回试管中,从而防止了倒吸.
点评 本题考查了实验装置的综合及应用,题目难度中等,涉及装置特点及使用方法、离子方程式、化学方程式书写等知识,注意掌握常见仪器装置的特点及使用方法,试题培养了学生的化学实验能力.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠和铁的熔化 | B. | 二氧化硅和生石灰的熔化 | ||
| C. | 碘和干冰的升华 | D. | 食盐和冰的熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
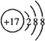 ;
;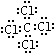 ,分子内含有极性键.
,分子内含有极性键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;该化合物的晶体类型离子晶体
;该化合物的晶体类型离子晶体查看答案和解析>>
科目:高中化学 来源: 题型:解答题
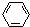 、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40g SO3气体所占有的体积为11.2L | |
| B. | 1mol固体NaHCO3所含有的阴阳离子总数为3NA | |
| C. | 1mol/L的CH3COOH溶液中,CH3COO-总数小于NA | |
| D. | 常温常压下,32gO2和O3的混合气体含氧原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(3)(4)(5) | B. | (3)(1)(4)(2)(5) | C. | (5)(1)(3)(2)(4) | D. | (5)(4)(3)(2)(1) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com